1、填空题 (3分)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是?
(填序号),写出反应⑥的化学方程式__?____。
参考答案:③?④?⑤? Ba(OH)2·8H2O+2NH4Cl=BaCl2 + 2NH3 ↑+ 10H2O或2NH3 ·H2O + 8H2O
本题解析:有能量放出的化学反应叫做放热反应,常见的放热反应有可燃物燃烧、酸碱中和反应、金属与酸的反应、大多数化合反应等。据此判断属于放热反应的有③④⑤;Ba(OH)2·8H2O与NH4Cl发生复分解反应,化学方程式为Ba(OH)2·8H2O+2NH4Cl=BaCl2 + 2NH3 ↑+ 10H2O或2NH3 ·H2O + 8H2O。
本题难度:一般
2、选择题 下列变化过程属于吸热反应的是(?)
(1) 液氨汽化 (2) 将胆矾加热变为白色粉末 (3) 浓硫酸稀释 (4) 氨催化氧化生成一氧化氮 (5) 酸碱中和生成水? (6) FeCl3溶于水显酸性
A.(1) (2) (6)
B.(1) (2) (4) (6)
C.(2) (5) (6)
D.(2) (4) ( 6)
参考答案:D
本题解析:吸热反应和放热反应都是化学反应,排除(1)(3),这两个是物理过程;剩下(2)、(4)(6)是属于化学反应且为吸热反应,(5)是化学反应但属于放热反应。
本题难度:简单
3、选择题 热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列关于能量变化的说法正确的是(?)
A.相同质量的水和冰相比较,冰的能量高
B.化学反应过程中能量的变化只有吸热和放热两种表现形式
C.化学反应既遵循质量守恒,也遵循能量守恒
D.已知C(石墨,s)==C(金刚石,s) ΔH>0,则金刚石比石墨稳定
参考答案:C
本题解析:冰熔化是吸热的,所以冰放热能力低于水的,A不正确。B不正确,也可以是以电能、光能的形式表现,B不正确。石墨生成金刚石水吸热反应,说明石墨的能量低于金刚石的,所以石墨比金刚石稳定,选项D不正确,因此正确的答案选C。
本题难度:一般
5、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是?。
(2)已知:

①合成氨的热化学方程式是?。
②降低温度,该反应的化学平衡常数K?.(填“增大”、“减小’’或“不变”)。
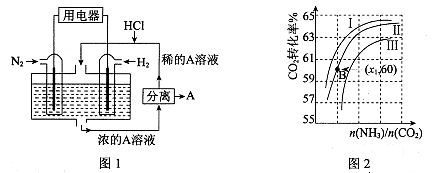
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是?,A是?。
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比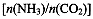 、水碳比
、水碳比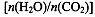 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是?。
②测得B点氨的转化率为40%,则x1?。
参考答案:(13分)
(1)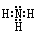 ?(2分)
?(2分)
(2)①N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
②增大
(3)N2+8H++6e-=2NH4+? (2分)? NH4Cl?(2分)
(4)Ⅲ? (1分);? 3?(2分)
本题解析:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是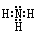
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) ?△H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
本题难度:困难