1、填空题 (13分) 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
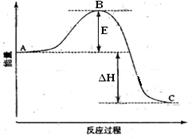
 (1)图中A、C分别表示?、?
(1)图中A、C分别表示?、?
(2) E的大小对该反应的反应热有无影响??。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低??
 (3)图中△H=?KJ·mol-1;
(3)图中△H=?KJ·mol-1;
 (4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
??、??
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H?(要求写出计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H?(要求写出计算过程)。
2、选择题 下列说法中,正确的是
? [? ]
A.C(石墨,s) = C(金刚石,s) △H>0,所以石墨比金刚石稳定
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.吸热反应只有在加热条件下才能发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH增大
3、选择题 下列物质不能导电的是()
A.氢氧化钠溶液
B.醋酸溶液
C.熔融氯化钾
D.FeSO 晶体
晶体
4、选择题 下列叙述中正确的是()
A.化反应一定有物质变化,不一定有能量变化
B.化合反应一定是放热反应
C.放热反应不需要加热就一定能发生
D.吸热反应不加热也可能发生
5、填空题 (共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为?。
②又已知H2O(l)=H2O(g)? ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是?kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是?。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)?△H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)?△H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)?△H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________?