1、选择题 某元素原子的次外层有2个电子,其最外层差一个电子即达稳定结构,该元素是
[? ]
A.Na
B.Cl
C.F
D.H
参考答案:C
本题解析:
本题难度:简单
2、选择题 某课外兴趣小组通过实验发现钾和钠的性质相似,下列说法中能最好地解释这个事实的是( )
A.都是金属元素
B.原子半径相差不大
C.最外层电子数相同
D.最高化合价相同
参考答案:C
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子,请回答下列问题:
(1)D元素的原子结构示意图为______.
(2)由A、B、C三种元素形成的化合物的电子式为______,这种化合物形成的晶体中所含的化学键类型有______.
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______(用离子方程式表示).
参考答案:A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,则E原子含有17个电子,故E为氯元素;A与C同主族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,B与D分别为同主族,原子序数B小于D,则B为氧元素,D为硫元素;原子序数C等于氧元素,C与氢元素为同主族,故C为钠元素.
(1)D为硫元素,原子核外电子数为16,有3个电子层,最外层电子数为6,原子结构示意图为
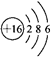
.
故答案为:

.
(2)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为
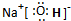
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键.
故答案为:
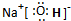
;离子键、共价键.
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该盐为NaClO,次氯酸钠属于强碱弱酸盐,在溶液中ClO-水解ClO-+H2O

HClO+OH-,使溶液呈碱性,溶液pH>7.
故答案为:ClO-+H2O

HClO+OH-.
本题解析:
本题难度:一般
4、填空题 现有甲、乙两种元素,第3周期元素甲最外层有2个电子,元素乙3p能级上的电子排布方式为

(1)写出甲、乙两元素的符号:甲_______,乙_______。
(2)甲、乙两元素形成的单质加热反应后的产物是_____,其为_______ (填“离子”或“共价”)化合物,它们发生反应的化学方程式为_________________。
参考答案:(1)Mg;S
(2)MgS;离子;Mg+S MgS
MgS
本题解析:
本题难度:一般
5、选择题 现有五种短周期主族元素x、Y、Z、W、R.其中X的原子半径时短周期最大的,Y的原子最外层电子数为m,次外层电子数为n,Z的原子L层电子数为m+n,M层电子数为m-n,W与Z同主族,R与Y原子的核外电子数之比为2:1.下列叙述错误的是( )
A.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是R>W>Z
B.Y的氢化物比R的氢化物稳定,Y的氢化物的熔沸点比R的氢化物的熔沸点低
C.Y分别与Z、W、R以两种元素组成的常见化合物共有5种
D.X与Y形成的两种化合物中,阴、阳离子的个数比均为1:2
参考答案:X的原子半径时短周期最大的,应为Na元素,Z的原子L层电子数为m+n,M层电子数为m-n,则m+n=8,Y的次外层电子数为n,则n=2,由此可知m=6,则可知Y为O元素,Z为Si元素,W与Z同主族,W应为C元素,R与Y原子的核外电子数之比为2:1则R的核外电子数为16,应为S元素,
A.Z、W、R分别为Si、C、S元素,非金属性Si<C<S,则最高价氧化物对应水化物的酸性强弱顺序是R>W>Z,故A正确;
B.Y为O元素,R为S元素,Y的氢化物为水,含有氢键,熔沸点比R的氢化物的熔沸点高,故B错误;
C.Y分别与Z、W、R以两种元素组成的常见化合物有SiO2、CO、CO2、SO2、SO3等5种,故C正确;
D.X与Y形成的两种化合物分别为Na2O、Na2O2,阴、阳离子的个数比均为1:2,故D正确.
故选B.
本题解析:
本题难度:一般