1、选择题 下图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4 溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是

[? ]
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH增大
D.烧杯中SO42-向Cu电极定向移动
2、填空题 重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
 ?
?
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
 ?
?
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:
 ?
?
①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。
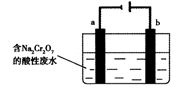
a电极的电极反应式是?,
b电极附近反应的离子方程式是?。
3、填空题 如图为相互串联的甲乙两电解池
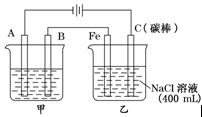
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是?极,材料是?,A电极反应为?。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈?色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为?;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为?。
4、选择题 若电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生672mL(标准状况下)气体时,下列叙述正确的是
A.电解后溶液的c(H+)="0.1mol/L"
B.阴极产物除了Cu,还有H2
C.要恢复到原来的浓度和pH,可以向溶液中加入一定量的CuCl2固体
D.在整个电解过程中,共转移了0.08mol电子,且在阴极上Cu2+得电子被氧化
5、填空题 如图(1)所示装置,甲槽中盛放AgNO3溶液,乙槽中盛放AlCl3和M(NO3)x(x≥1,x为正整数)的混合溶液,其中甲槽中一个电极为锌电极,其余均为石墨电极,且接通线路前各电极质量相等。接通线路一段时间,测得乙槽中a、d两极所得气体的体积(标准状况下)随时间变化的关系如图(2)所示。
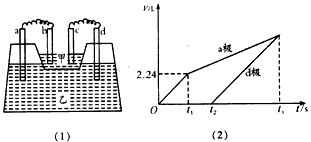
请回答下列问题:
(1)d极为________极,c极的电极反应方程式为____________________
(2)t2时刻,测得b、c两电极的质量相差32.8 g,b、d两电极质量相差22.8 g,则:
①M(NO3)x的化学式为_________。
②t1~t2时,乙槽中的反应方程式为__________________。
③t2~t3时,乙槽中溶液pH____(填“增大”“减 小”或“不变”)。
④如果在t3时刻,反应刚好停止(电极都没用完),则 n(AgNO3):n[M(NO3)x]=____________。