1、选择题 关于下列各实验装置的叙述中,正确的是(?)
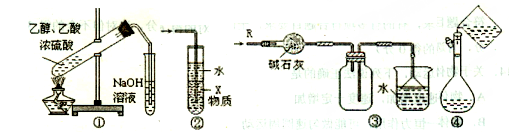
A.装置①制备乙酸乙酯
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥、收集Cl2,并吸收多余的Cl2
D.装置④配制一定物质的量浓度的溶液时转移液体
参考答案:B
本题解析:A、制备乙酸乙酯应用饱和碳酸钠溶液吸收产品,导管口末端应位于饱和碳酸钠溶液液面上,与题给装置不符,错误;B、装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸,该装置为隔离法防倒吸,正确;C、氯气能与碱石灰反应,不能用碱石灰干燥,氯气密度比空气大,应用向上排空气法收集,错误;D、配制一定物质的量浓度的溶液时转移液体应用玻璃棒引流,错误。
本题难度:一般
2、选择题 下列有关实验的操作或叙述错误的是
A.为使层析实验达到较好分离效果,所配试样浓度应较大,点样时试样斑点较小
B.淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.分光光度计可通过测定反应物浓度变化,从而确定反应物的化学反应速率
D.抽滤完毕后,需停止抽滤时,一定要先拔下抽气泵与吸滤瓶相连的橡皮管,再关闭水龙头,然后取漏斗滤纸上的沉淀
参考答案:B
本题解析:A.纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的。为使层析实验达到较好分离效果,所配试样浓度应较大,点样时试样斑点较小.正确。B.淀粉在稀硫酸的作用下水解后,滴加NaOH溶液中和催化剂硫酸至碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经水解,但水解程度不能确定。错误。C.分光光度计的用途是一检定物质;二与标准物及标准图谱对照;三 比较最大吸收波长吸收系数的一致性;四 纯度检验;五 推测化合物的分子结构;六.络合物组成及稳定常数的测定等。也可可通过测定反应物浓度变化,从而确定反应物的化学反应速率。正确。D. 抽滤就是减压过滤。抽滤完毕后,需停止抽滤时,先拔下抽气泵与吸滤瓶相连的橡皮管再关闭水龙头,然后取漏斗滤纸上的沉淀。符合抽滤操作过程的要求。正确。
本题难度:一般
3、选择题 下列各项实验操作正确的是
A.实验室规定:所有实验剩余的药品均不应放回原药品瓶内
B.为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
C.在转移固体需使用玻璃棒
D.为了防止容量瓶漏水,可在玻璃塞上涂上凡士林
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列事实可用同一原理解释的是?
A.NO2和溴蒸气分别通入盛有AgNO3溶液的洗气瓶均被吸收而褪色
B.萘片、碘片、氯化铵晶体分别置于大试管中加热,试管底部物质都会逐渐消失
C.SO2和Cl2都能使品红溶液褪色
D.福尔马林、葡萄糖溶液与新制Cu(OH)2悬浊液共热,都会有砖红色沉淀产生
参考答案:D
本题解析:A是NO2易溶于水,而溴在溶液中歧化为Br-和HBrO,Br-与Ag+生成AgBr↓;B中萘片、碘片受热升华,NH4Cl则受热分解;C中SO2能和某些有色物质形成无色的加合物,湿氯气的漂白作用则是由于其歧化生成的HClO强氧化性所致;D是醛的特征反应之一。
本题难度:一般
5、选择题 有一瓶无色气体可能有H2S、CO2、HCl、HBr、SO2五种气体中的一种或几种。将其通入氯水中,得无色透明溶液。将这种溶液分为两份。向一份中加入用盐酸酸化的BaCl2溶液,产生了白色沉淀。向另一份中加入用硝酸酸化的AgNO3溶液,产生了白色沉淀,则下列结论中正确的是……( )
A.肯定有HCl、SO2
B.可能有HBr、CO2
C.肯定没有CO2、H2S、HBr
D.以上结论都不正确
参考答案:D
本题解析:由题意,无色气体通入氯水中得无色溶液知源气体中肯定无H2S、HBr;又,无色溶液加入盐酸酸化的BaCl2溶液产生了白色沉淀,知白色沉淀为BaSO4,原气体中含有SO2,不能确定是否含有CO2;所得无色溶液加入用硝酸酸化的AgNO3溶液也产生了白色沉淀,但不能据此判断原混合气体中含有HCl,因为是通入氯水中所得溶液,反应自身会引入Cl-,综上所述正确选项为D
本题容易错选A,原因是没注意到同入氯水中时已入了Cl-,原混合气体中有无HCl均可于硝酸酸化的硝酸银溶液产生白色沉淀。
本题难度:一般