1、简答题 实验室常用的浓盐酸的密度为1.17g?mL-1,质量分数为36.5%.试计算:
(1)此浓盐酸的物质的量浓度是多少?
(2)取此浓盐酸50mL,用蒸馏水稀释到250mL,稀释后盐酸的物质的量浓度是多少?
参考答案:(1)密度为1.17g?mL-1,质量分数为36.5%的浓盐酸的物质的量浓度为1000×1.17×36.5%36.5mol/L=11.7mol/L,
答:该浓盐酸的物质的量浓度为11.7mol/L;
(2)根据稀释定律,稀释前后溶质HCl的物质的量不变,令稀释后盐酸的浓度为c,则:
50mL×11.7mol/L=250mL×c
解得:c=2.34mol/L
答:稀释后盐酸的物质的量浓度是2.34mol/L.
本题解析:
本题难度:一般
2、选择题 现有CuO和Fe2O3的混合物a g,向其中加入1 mol·L-1的HNO3溶液200 mL恰好完全反
应,若将2a g该混合物用足量CO还原,充分反应后剩余固体质量为
A.(2a-1.6)g
B.2(a-1.6)g
C.(a-1.6)g
D.3.2 g
参考答案:B
本题解析:设CuO和Fe2O3的物质的量分别为x、y。则有 解得:x=(3a-16)/80? y=(8-a)/80,计算知a g混合物中Cu和Fe的质量是(a-1.6)g,所以B正确。
解得:x=(3a-16)/80? y=(8-a)/80,计算知a g混合物中Cu和Fe的质量是(a-1.6)g,所以B正确。
本题难度:一般
3、填空题 0.2mol NH3 质量为________,在标准状况下的体积为_______,所含氢原子的物质的量为_______,将其溶于水配制成1L溶液,所得溶液中溶质的物质的量浓度为________。
参考答案:3.4g;4.48L;0.6mol;0.2mol/L
本题解析:
本题难度:简单
4、填空题 (3分)0.6 mol的氧气与0.4 mol臭氧 O3质量之比为?, 分子个数之比为?, 氧原子个数之比为? ?。
?。
参考答案:1:1?3:2?1:1
本题解析:略
本题难度:简单
5、计算题 (4分)现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度为_________
(2)将此浓盐酸用蒸馏水稀释至200mL,则稀释后溶液中Cl-的物质的量浓度与______ mol/L的氯化镁溶液中的Cl-浓度相同。
参考答案:(1)11.8mol/L;(2)1.475
本题解析:(1)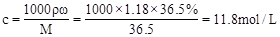
(2)稀释后c(Cl-)=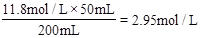 。一个MgCl2中有2个Cl-,所以与该盐酸中Cl-的物质的量浓度相等的MgCl2的浓度为1.475 mol/L。
。一个MgCl2中有2个Cl-,所以与该盐酸中Cl-的物质的量浓度相等的MgCl2的浓度为1.475 mol/L。
点评:本题基础简单,主要根据两种浓度的转换公式和稀释公式来计算。
本题难度:一般