1、选择题 下列关于指定粒子的构成叙述中,正确的是
A.37Cl与39K中所含的中子数不同
B.12C和14C是不同的核素,他们的质子数相等
C.H3O+与OH-具有相同的质子数和电子数
D.15N2与14N2互为同位素
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列各组顺序的排列不正确的是 (? )
A.原子半径:Na<Mg<Al
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO4<H2CO3<H2SO4
D.沸点:H2O>H2Se>H2S
参考答案:A
本题解析:同周期自左向右,原子半径逐渐减小,则选项A不正确,应该是原子半径:Na>Mg>Al。根据元素周期律可知,选项B、C都是正确的。D中水分子间存在氢键,沸点最高,正确,答案选A。
点评:该题中等难度的试题,试题基础性强,注重考查学生对元素周期律了解掌握程度,有利于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。该题需要注意的选项D中氢键对熔沸点的影响。
本题难度:一般
3、选择题 原子核外P能层和p能级可容纳的最多电子数分别为
A. 32和2
B. 50和6
C. 72和6
D. 86和10
参考答案:C
本题解析:P能层是第六能层,根据每个能层最多能容纳2n2个电子,所以P能层最多能容纳72个电子,p能级有3个原子轨道,每个原子轨道最多容纳2个电子,所以p能级最多容纳6个电子。答案选C。
点评:本题基础,只要根据基本概念解答即可。
本题难度:简单
4、填空题 (12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
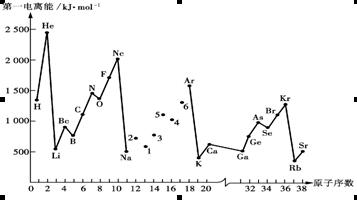
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒)?②E(砷)<E(硒)?③E(溴)>E(硒)?④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
参考答案:(1)略(2分)?(2)从上到下依次减小;(2分)
(3)第三周期,ⅤA族;(2分)?
(4)因同主族上一周期的元素的氢化物分子间存在氢键;(2分)?(5)①③(2分)
(6)F?__H---F? O___H---O? F__H---O? O__H---F? (2分)
本题解析:(1)Na——Ar之间六种元素第一电离能的变化规律为: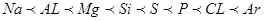 ;
;
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是:从上到下依次减小;
(3)上图中5号元素即P在周期表中的位置是第3周期第VA族;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:同主族上一周期的元素的氢化物分子间存在氢键;
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是:E(砷)>E(硒);E(溴)>E(硒);
(6)用氢键表示式写出HF溶液中存在的所有氢键为:F?__H---F? O___H---O? F__H---O? O__H---F
本题难度:一般
5、选择题 47Ag有两种同位素,在自然界所占的原子百分比几乎相同,若Ag的近似相对原子质量为108,则这两种同位素的中子数为:
A.106和110
B.57和63
C.153和73
D.60和62
参考答案:D
本题解析:元素的相对原子质量是该元素各种同位素原子所占的一定百分比算出的平均值。设这两种同位素的中子数分别为x和y,则有(47+x)×50%+(47+y)×50%=108,解得x+y=122。所以答案是D。
本题难度:简单