1、选择题 往硝酸银、硝酸镁、硝酸铜的混合溶液中加入一定量铁粉,充分反应后,再过滤.下列情况不可能存在的是
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
C.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
D.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
参考答案:A
本题解析:分析:氧化性:Ag+>Cu2+>Fe2+>Mg2+,在金属活动性顺序中,Mg>Fe>Cu>Ag,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中加入一些铁粉,Mg>Fe>Cu>Ag,铁不会与硝酸镁反应,故滤液中一定含有硝酸镁,铁与硝酸银反应生成硝酸亚铁和银,铁与硝酸铜反应生成硝酸亚铁和铜,生成的铜与硝酸银能反应生成硝酸铜和银.
解答:A.在硝酸银与硝酸铜同时存在时,Fe先与硝酸银充分反应后再与硝酸铜反应,当滤纸上有Cu时,说明硝酸银全部参加了反应.因此滤液中一定没有硝酸银,即溶液中一定不存在Ag+,故A错误;
B.当铁粉量不足时,只与部分硝酸银反应,生成银,仍有硝酸银剩余,由于氧化性:Ag+>Cu2+>Fe2+>Mg2+,则滤液中有
Ag+、Cu2+、Fe2+、Mg2+,故B正确;
C.当铁粉适量时,能与混合液中的硝酸银和硝酸铜恰好完全反应,生成Ag和Cu,滤液中有Fe2+、Mg2+,故C正确;
D.当铁粉过量时,与混合液中的硝酸银和硝酸铜完全反应,生成Ag和Cu,Fe有剩余,滤液中有Fe2+、Mg2+,故D正确.
故选A.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义进行,注意离子的氧化性,判断离子反应的先后顺序.
本题难度:一般
2、填空题 (6分)已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。经过一定条件的转化二者均可转化为金属单质,根据下列框图转化回答问题:
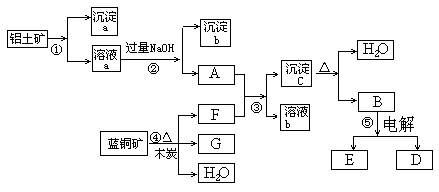
(1)写出①的离子方程式:______________________、_____________________。
(2)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:
______________?_______、___________?___________。
(3)若过量F与A反应,溶液b的成分是:__?____(写化学式)。
参考答案:
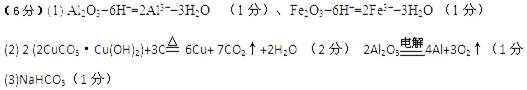
本题解析:略
本题难度:简单
3、选择题 合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表中的数据,不能形成合金的是?(?)
?
| Na
| Cu
| Al
| Fe
|
熔点/℃
| 97.8
| 1083
| 66 0 0
| 1535
|
沸点/℃
| 883
| 2567
| 2467
| 2750
|
? A.Cu和Al ? B .Fe和Cu? C.Cu和Na ? D.Al和Na
.Fe和Cu? C.Cu和Na ? D.Al和Na
参考答案:C
本题解析:略
本题难度:简单
4、选择题 (2009北京宣武一次质检,5)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为(?)
A.5.4 g
B.3.6 g
C.2.7 g
D.1.8 g
参考答案:A
本题解析:等物质的量的盐酸和NaOH与足量铝粉反应时生成H2的体积比为1∶3,所以此题投入的铝粉对盐酸来说过量,对NaOH来说不足,用盐酸的量求出盐酸与铝产生的n(H2)="0.15" mol,所以NaOH与铝产生的n(H2)="0.15" mol×2="0.3" mol,需要n(Al)="0.2" mol,即5.4 g。
本题难度:简单
5、填空题 (16分) 某校化学兴趣小组的同学经查阅资料得知:铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,但奇怪的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组的同学对铝表面的氧化膜进行了探究,其过程如下,请完成下列填空。
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软,轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的熔点________(填“高于”或“低于”)内层铝的熔点,并将其裹住,所以不易发生滴落现象。
(2)取纯净的铝箔,包裹住一小块金属钠后放入水中无现象;将该铝箔用针刺些小孔后再包裹住一小块金属钠后放入水中,迅速就有大量的气泡产生。试解释其中的原因,并写出相关的化学方程式:___________? ___________________。
(3)用砂纸打磨一铝片,使其表面变粗糙,再将其放入CuSO4稀溶液中,2~3 min后有少量红色固体附着在其表面。试写出产生红色固体的离子方程式:??。
(4)把两块未用砂纸打磨过的铝片都浸入氢氧化钠溶液中,片刻后其表面产生无色气体。试写出铝的氧化膜与氢氧化钠溶液反应的离子方程式:___________________________。
(5)另取一铝制易拉罐,收集满一罐CO2,加入过量的浓氢氧化钠溶液,立即把口封闭。可以发现易拉罐“咔咔”作响,并变瘪了;过一会后,易拉罐又会作响并鼓起来。试解释为什么,写出有关的离子方程式?
参考答案:(1)高于;(2)铝与水不反应,钠与水迅速反应产生氢气;生成的氢氧化钠溶液又溶解金属铝再产生氢气。相关的化学方程式为:2Na+2H2O=2NaOH+H2↑; 2Al+2 NaOH+ 2H2O=2 NaAlO2+3H2↑(3)2Al+3Cu2+=2Al3++3Cu ; (4)Al2O3+2OH-=2AlO2-+H2O; (5) 开始时浓氢氧化钠溶液吸收CO2引起易拉罐内压强减小,导致易拉罐变瘪,离子方程式为:CO2+2OH-= CO32-+ H2O;过一会后暴露出来的Al又与氢氧化钠溶液反应生成了H2,压强又逐渐增大,导致易拉罐又重新鼓了起来,离子方程式为:2Al+2OH-+ 2H2O=2AlO2-+3H2↑
本题解析:(1)铝在酒精灯火焰上加热,铝表面生成氧化铝,氧化铝的熔点高于铝,所以内部的铝熔化,但外面的氧化铝并不熔化,好象有一层膜兜着。
(2)铝包在钠表面,铝与水不反应。用针刺些小孔后钠与水生成氢氧化钠和氢气,生成的氢氧化钠溶液又与铝产生氢气。反应方程式为2Na+2H2O=2NaOH+H2↑; 2Al+2 NaOH+ 2H2O=2 NaAlO2+3H2↑。
(3)用砂纸打磨铝片,表面的氧化铝被除去,铝与硫酸铜溶液反应置换出铜。
(4)氧化铝与氢氧化钠溶液离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(5)开始时浓氢氧化钠溶液吸收CO2引起易拉罐内压强减小,导致易拉罐变瘪,离子方程式为:CO2+2OH-= CO32-+ H2O;过一会后暴露出来的Al又与氢氧化钠溶液反应生成了H2,压强又逐渐增大,导致易拉罐又重新鼓了起来,离子方程式为:2Al+2OH-+ 2H2O=2AlO2-+3H2↑
点评:通常情况下镁、铝的表面有一层致密的氧化物保护膜能保护内部的金属不被氧化,所以镁、铝不需要密封保存。
本题难度:一般