1、选择题 X、Y、Z三种金属,X、Y组成原电池时,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。X、Y、Z的活泼性顺序是
[? ]
A.X>Z>Y?
B.Z>Y>X?
C.X>Y>Z?
D.Y>X>Z
参考答案:C
本题解析:
本题难度:简单
2、填空题 (15分)回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:
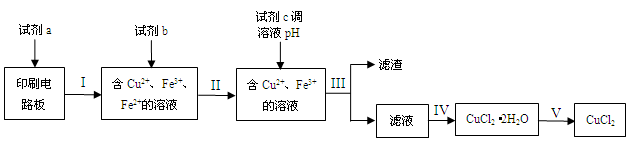
已知部分物质开始沉淀和沉淀完全时的pH如下表:
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)2
| 7.6
| 9.6
|
Fe(OH)3
| 2.7
| 3.7
|
Cu(OH)2
| 4.4
| 8.0
|
请回答下列问题:
①步骤III的操作名称是 。
②下列试剂中,可以作为试剂a的是 。
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行? (填“是”或“否”),理由是 。
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g) △H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g) △H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g) △H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H = 。
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是 。
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是 L。
参考答案:(1)①过滤(2分)②C(2分)③否(1分);不能除去亚铁离子,影响所得氯化铜纯度(2分)(2)-320KJ/mol(3分)(3)H2O2+2H++2e-=2H2O(2分)(4)4(3分)
本题解析:(1)①操作是将固体和液体分开,用过滤。②利用印刷电路板上的铜制备CuCl2,反应后的溶液中有铁元素,说明使用的是氯化铁,选C。③需要将溶液中的铁元素变成沉淀,若以氢氧化亚铁的沉淀形式,溶液的pH在7.6到9.6之间,而铜离子已经沉淀,不能分离,若以氢氧化铁的形式沉淀,pH2.7开始沉淀,到3.7沉淀完全,这时铜离子没有开始沉淀,所以要将亚铁氧化成铁离子才能调节溶液的pH值进行沉淀,所以不可行,选否;因为那样不能除去亚铁离子,会影响所得氯化铜纯度。(2)根据盖斯定律,将方程式进行四则运算,③+②/2-②,则反应热=+64-196/2-286=-320KJ/mol。(3)原电池中铜做负极,过氧化氢在正极反应得到电子,电极反应为:H2O2+2H++2e-=2H2O。(4)根据离子方程式分析:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,生成3摩尔硫酸铜,需要3摩尔铜,2摩尔硝酸,所以硝酸的体积为2/0.5=4升。
考点:原电池的电极反应的书写,物质的分离,盖斯定律
本题难度:困难
3、选择题 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e-===Fe2+
B.正极发生的反应为:2H2O+O2+2e-===4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
参考答案:A
本题解析:2Fe+2H2O+O2===2Fe2++4OH-。A项,负极反应:2Fe-4e-===2Fe2+;B项,正极反应:2H2O+O2+4e-===4OH-;C项,电池是将化学能转化成电能的装置;D项,钢柱在空气与水交界处因与O2接触而更易发生电化腐蚀。
本题难度:简单
4、选择题 理论上,不能设计为原电池的化学反应是:
A.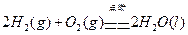
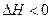
B.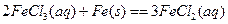
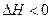
C.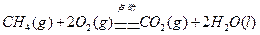
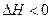
D.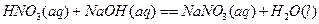
参考答案:D
本题解析:略
本题难度:简单
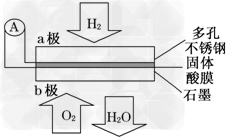
5、选择题 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是
[? ]
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-===4OH-
C.每转移0.1?mol电子,消耗1.12?L的H2
D.H+由a极通过固体酸电解质传递到b极
参考答案:D
本题解析:
本题难度:一般