|
|
|
高中化学必备知识点《水的电离平衡》高频考点巩固(2019年模拟版)(三)
2020-08-13 05:50:12
【 大 中 小】
|
1、填空题 在a mL醋酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,滴定曲线如图所示。
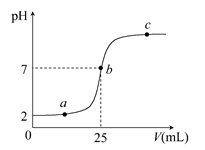
(1)醋酸溶液浓度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b点,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在____;
A.2与a之间 B.a与b之间
C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是________。
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
2、选择题 下列说法正确的是
A.强电解质一定易溶于水
B.钢铁在海水中发生电化腐蚀时,铁是阳极被氧化
C.对可逆反应,升高温度一定存在v(正)>v(逆)
D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小
|
3、选择题 在10mL pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是
A 0.01mol/L CH3COOH B 0.01mol/L HNO3
C pH=2的H2SO4溶液 D pH=2的CH3COOH溶液
4、选择题 常温下,下列溶液中c(H+)最小的是
A.pH=4的H2SO4溶液
B.pH=3的CH3COOH溶液
C.c(OH-)=1×10-11mol·L-1
D.c(H+)=1×10-3mol·L-1
|
5、填空题 (18分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。

(1)装置③的作用是 装置①的作用是
(2)装置②中制备ClO2的化学方程式为 ;产生ClO2的还原剂是装置④中制备NaClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果 (填“偏高”或“偏低”),原因用离子方程式表示为 。
