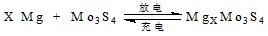|
|
|
高中化学知识点讲解《常见的化学电源》考点特训(2019年冲刺版)(四)
2020-08-13 05:55:44
【 大 中 小】
|
1、填空题 聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
AlT/(mol·L-1)
| Ala/%
| Alb/%
| A1c/%
| 0.208
| 1.4
| 86.6
| 12.0
| 0.489
| 2.3
| 86.2
| 11.5
| 0.884
| 2.3
| 88.1
| 9.6
| 1.613
| 3.1
| 87.0
| 9.9
| 2.520
| 4.5
| 88.2
| 7.3
|
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1。当T>80℃时,AlT显著下降的原因是 。
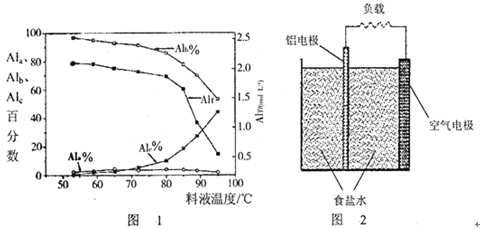
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g) △H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图2所示,写出该电池正极的电极反应式 。
参考答案:(1)13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①减小;②Al3++3H2O=Al(OH)3(胶体)+3H+;③温度升高,水解程度加大,产生氢氧化铝沉淀;(3)a+b;>;(4)O2+2H2O+4e-=4OH-。
本题解析:(1)根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①在一定温度下,AlT越大,Ala%越大,Alc%越小,所以pH减小;②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:Al3++3H2O=Al(OH)3(胶体)+3H+;③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图所示。当T>80℃时,AlT显著下降的原因是温度升高,水解程度加大,产生氢氧化铝沉淀;(3)①+②整理可得Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H =△H1+△H2 =-(a+b)kJ/mol;反应①常压下在1900℃的高温下才能进行,说明该反应是吸热反应,△H>0;(4)在该铝空气电池中活动性强的Al作负极,活动性弱的C作正极。由于是在中性介质中,所以发生的是吸氧腐蚀。该电池正极的电极反应式是O2+2H2O+4e-=4OH-。
考点:考查物质的存在形式与溶液酸碱性的关系、离子方程式的书写、反应的热效应的判断、原电池反应原理的知识。
本题难度:困难
2、选择题 一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是
( )
A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是负极
C.该电池的正极反应为:4H++O2+4e-=2H2O
D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2molC2H5OH,阳极产生标准状况下气体的体积为26.88L
|
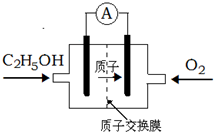
参考答案:A.电池工作时,电源内部的阳离子从负极区向正极区迁移,所以H+从负极区向正极区迁移,故A错误;
B.燃料电池中,燃料在负极失电子,所以通入乙醇的电极是负极,故B正确;
C.正极氧气得到电子被还原,电极反应式为4H++O2+4e-═2H2O,故C正确;
D.每消耗0.2molC2H5OH转移2.4mol电子,惰性电极电解饱和NaCl的水溶液阴极产生氢气,生成1molH2转移2mol电子,所以转移2.4mol电子时生成氢气为1.2mol,所以气体体积为26.88L,故D正确.
故选A.
本题解析:
本题难度:一般
3、选择题 分别放在0.1mol·L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是
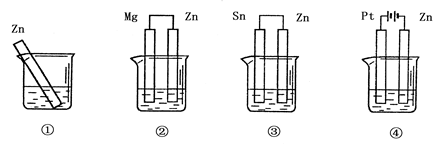
A.④>③>②>①
B.③>①>②>④
C.④>③>①>②
D.②>③>④>①
|
参考答案:B
本题解析:金属腐蚀的快慢:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,因此B正确。
考点:考查金属腐蚀的快慢及电化学原理。
本题难度:一般
4、选择题 目前一种新型的电池--质子交换膜燃料电池备受消费者青睐,其工作原理如图所示,下列叙述正确的是( )
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式:O2+2H2
2H2O
D.正极的电极反应式为O2+4H++4e-→2H2O
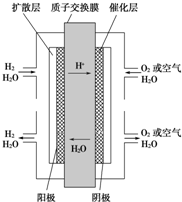
参考答案:A.通入氧气的电极是正极,正极上得电子发生还原反应,故A错误;
B.通入氢气的电极是负极,负极上失电子发生氧化反应,故B错误;
C.电池反应式为O2+2H2=2H2O,故C错误;
D.正极上氧气得电子和和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故D正确;
故选:D.
本题解析:
本题难度:一般
5、选择题 镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为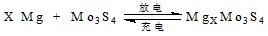
下列说法正确的是
[? ]
A.放电时,Mo3S4发生氧化反应
B.放电时,正极反应式:Mo3S4+2xe-→Mo3S42x-
C.充电时,Mg2+向阳极迁移
D.充电时,阳极反应式:xMg2++2xe-→xMg
参考答案:B
本题解析:
本题难度:一般