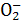1、填空题 将FeCl3溶液与NH4SCN溶液混合发生如下反应
①Fe3++SCN- Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2
红色 深红色
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001 mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4 mol/L,c[Fe(SCN)2+]约为1.5×10-4 mol/L,c[Fe(SCN)2+]约为5×10-6 mol/L,则反应②的平衡常数K2为 。
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是 。仔细观察,滴加NH4SCN溶液时,混合液颜色更深一些,其原因是 。
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式 ,继续滴加H2O2,溶液褪色,产生大量能够使澄清石灰水变浑浊的气体且硫氰根中氮元素全部转化为N2,向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成。写出H2O2与SCN-反应的离子方程式 。
(4)为测定某溶液中c(Cl-),取待测液V1 mL,向其中加入V2 mL浓度为c2 mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2·12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3 mL。(已知Ag++SCN- = AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(Ag Cl)=1.56×10-10)。请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将 。(填“偏高”,“偏低”或不变)。
②最终测得c(Cl-)= mol/L。
2、选择题 下列反应的离子方程式正确的是
A.AgCl不溶于稀硝酸,但可溶于氨水中:AgCl +2 NH3·H2O = [Ag(NH3)2]++ Cl-+2H2O
B.双氧水中滴加酸性高锰酸钾,溶液紫红色褪去:6H++ 2MnO4- + H2O2= 2Mn2+ + 3O2 ↑+ 4H2O
C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+2H2O= 4Fe3++4 OH-
D.乙炔气体中混有的硫化氢,可通过盛有CuSO4溶液的洗气瓶:Cu2+ + S2- = CuS↓?
3、选择题 下列离子方程式与所述事实相符且正确的是 ( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O =HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl- 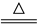 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是 ( )
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是 ( )