1、计算题 PCl5的热分解反应如下:PCl5(g)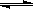 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
参考答案:(1)K=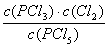 或K=
或K=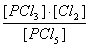 (2分)
(2分)
(2)K=0.45(2分)
本题解析:(1)化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是K=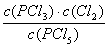 。
。
(2)? PCl5(g)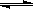 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
起始浓度(mol/L)? 0.2? 0? 0
转化浓度(mol/L)? 0.15? 0.15? 0.15
平衡浓度(mol/L)? 0.05? 0.15? 0.15
所以该反应的平衡常数是
点评:在可逆反应的计算中,往往采用三段式进行。
本题难度:一般
2、选择题 下列事实中,不能用勒沙特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.工业合成氨时选择铁做催化剂能极大加快反应速率
C.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
参考答案:BC
本题解析:勒夏特列原理是改变影响化学平衡移动的一个因素,平衡朝减弱这种改变的方向移动。B、催化剂不影响平衡移动,C、盐酸为强酸,稀释过程,没有平衡移动。
本题难度:一般
3、选择题 密闭容器中存在化学反应: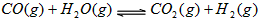 当反应容器中充入1molCO和1mol水蒸气,在一定条件下达到平衡时生成了0.67molCO2,当充入的水蒸气改为4mol,其它条件不变,平衡时生成的CO2的物质的量可能为
当反应容器中充入1molCO和1mol水蒸气,在一定条件下达到平衡时生成了0.67molCO2,当充入的水蒸气改为4mol,其它条件不变,平衡时生成的CO2的物质的量可能为
[? ]
A.0.5mol
B.1mol
C.0.95mol
D.0.67mol
参考答案:C
本题解析:
本题难度:一般
4、选择题 一定温度下,可逆反应H2(g)+I2(g) 2HI(g)达到化学平衡状态的标志是(?)
2HI(g)达到化学平衡状态的标志是(?)
A.混合气体的压强不再变化
B.混合气体的颜色不再变化
C.反应速率v(H2)="0.5v" (HI)
D.c (H2):c(I2):c(HI)=1:1:2
参考答案:B
本题解析:判断一个反应是否达到平衡状态的实质是正逆反应速率相等,标志是所给条件是否从“变”达到“不变”。A该反应气体分子总数前后一样,故压强始终不变;B碘蒸气为紫色,随着反应的进行,容器内气体的颜色逐渐变浅;C反应速率之比始终与化学计量系数之比相等,故不能用于判断反应是否达到平衡状态;D各物质的浓度之比与化学计量系数之比相同,与反应是否达到平衡无关系。故答案选B。
点评:判断一个反应是否达到平衡状态,是历年高考的重点。考生在备考过程中应抓住实质、通过标志进行分析。难度中等,一般以选择题出现。
本题难度:一般
5、选择题 某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应: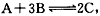 若保持温度和压强不变,达到平衡时容器的体积为VL,其中C 气体的体积占10%。下列推断正确的是
若保持温度和压强不变,达到平衡时容器的体积为VL,其中C 气体的体积占10%。下列推断正确的是
[? ]
①原混合气体的体积为1.2 L ②原混合气体的体积为1.1 L
③反应达到平衡时气体A消耗掉0.05 V L ④反应达到平衡时气体B消耗掉0.05 V L
A.②③
B.②④
C.①③
D.①④
参考答案:A
本题解析:
本题难度:一般