|
高考化学试题《化学反应与能量》试题强化练习(2019年最新版)(六)
2020-08-13 06:15:59
【 大 中 小】
|
1、选择题 下列反应属于吸热反应的是 ( )
A.碳在氧气中的燃烧
B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H2O与NH4Cl反应
D.锌粒与稀H2SO4反应制取H2
|
参考答案:C
本题解析:略
本题难度:简单
2、选择题 能正确表示下列反应的离子方程式是
A.金属铝溶于稀硫酸中:Al+2H+═A13++H2↑
B.碳酸钙溶于稀硝酸中:CO+2H+═H2O+CO2↑
C.氢氧化钡溶液和盐酸反应:H++OH-═H2O
D.铁加入硫酸铜溶液中:2Fe+Cu2+=2Fe2++Cu
参考答案:C
本题解析:分析:A.电荷不守恒;
B.碳酸钙在离子反应中保留化学式;
C.强酸与强碱反应生成可溶性盐和水;
D.电荷不守恒.
解答:A.金属铝溶于稀硫酸中的离子反应为2Al+6H+═2A13++3H2↑,故A错误;
B.碳酸钙溶于稀硝酸中的离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故B错误;
C.氢氧化钡溶液和盐酸反应生成氯化钡和水,离子反应为H++OH-═H2O,故C正确;
D.铁加入硫酸铜溶液中的离子反应为Fe+Cu2+=Fe2++Cu,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,注意利用电荷守恒来分析,涉及氧化还原反应的离子反应还应遵循电子守恒,题目难度不大.
本题难度:简单
3、选择题 一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的下列物质,其中一定不能达到目的的是
A.氯化钠溶液
B.水
C.醋酸钾溶液
D.硫酸铜固体
参考答案:D
本题解析:A可以,加入氯化钠溶液相当于稀释稀硫酸;B可以,加水稀释,硫酸浓度减小;C可,醋酸钾与硫酸反应生成弱酸使溶液中氢离子浓度减小,但氢离子的总物质的量不变;D错,加入硫酸铜固体,可与锌发生反应从而形成了原电池,使化学反应速率加快;
本题难度:一般
4、选择题 加Al能产生H2的溶液中,一定可以大量共存的是
A.Na+、NO3-、Cl-、Mg2+
B.NH4+、K+、Cl-、ClO-
C.NH4+、K+、Cl-、SO3?2-
D.Cl?-、Na+、K+、SO42-
参考答案:D
本题解析:分析:加Al能产生H2的溶液,为酸或强碱溶液,根据离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答:加Al能产生H2的溶液,为酸或强碱溶液,
A.酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,碱溶液中OH-、Mg2+结合生成沉淀,不能共存,故A错误;
B.酸溶液中H+、Cl-、ClO-发生氧化还原反应,碱溶液中OH-、NH4+结合生成弱电解质,不能共存,故B错误;
C.碱溶液中OH-、NH4+结合生成弱电解质,酸溶液中H+、SO32-结合生成水和气体,则不能共存,故C错误;
D.无论酸或强碱溶液中该组离子之间不反应,能共存,故D正确;
故选D.
点评:本题考查离子的共存,注意习题中的信息判断溶液的酸碱性为解答的前提,侧重氧化还原反应的考查,也为解答的难点,题目难度中等.
本题难度:困难
5、填空题 红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
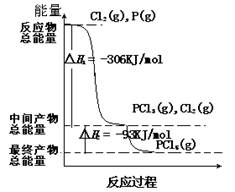
根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
参考答案:(每空2分)
(1)P(s) + 3/2 Cl2(g)=PCl3(g) △H =" -306" KJ/mol
(2)PCl5(g) = PCl3(g) + Cl2(g) △H =" +93" kJ?mol?1
(3)25% ; 0.0667;大于;大于;
(4)-399 KJ/mol ;
本题解析:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H="-306" kJ/mol,热化学方程式为:P(s)+3/2Cl2(g)
本题难度:一般
|