1、选择题 由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为
[? ]
A.29∶8∶13
B.22∶1∶14
C.13∶8∶13
D.26∶16∶13
参考答案:CD
本题解析:
本题难度:一般
2、简答题 某条件下,已知由C2H2和CO2组成的混合气体的密度为相同条件下H2密度的14.5倍,则混合气体中V(C2H2):V(CO2)=______.
参考答案:C2H2和CO2组成的混合气体的密度为相同条件下H2密度的14.5倍,则混合气体的平均相对分子质量为14.5×2=29,
设混合气体中含有xmolC2H2,ymolCO2,
则有:26x+44yx+y=29,
解之得:x:y=5:1,
在相同条件下,气体的体积之比等于物质的量之比,则体积之比为5:1,
故答案为:5:1.
本题解析:
本题难度:一般
3、选择题 设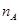 为阿伏加德罗常数的数值,下列说法正确的是
为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol CH5+所含电子数为8nA
B.标准状况下,11.2L Br2中Br原子数为nA
C.1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA
D.18 g的D216O中含有的中子数为9 NA
参考答案:D
本题解析:A. 1 mol CH5+所含电子数为10nA,错误;B.溴为液体,不适用于摩尔体积,错误;C. 1mol/L的Al2(SO4)3溶液,未说明体积,所以不能得出Al3+的数目小于2NA,错误;D.18g÷20g/mol×10NA=9NA,正确。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,3.2 g O3所含电子数为1.6NA
B.标准状况下,2.24 L CCl4中含有的C—Cl键的数目为0.4 NA
C.标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为2NA
D.将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+
参考答案:AC
本题解析:A.常温常压下,3.2 g O3所含电子数为3.2 g /48g/mol·24=1.6mol,即1.6NA,该选项正确;
B.标准状况下, CCl4为液态,2.24 L CCl4中含有的C—Cl键的数目不为0.4 NA,该选项不正确;
C.标准状况下,11.2 L NO与11.2 L O2分别含有1mol原子,混合后所含原子数不变,即为2NA,该选项正确;
D.将0.1 mol 氯化铁溶于1 L水中,由于铁离子的水解,所得溶液含有少于0.1 NA Fe3+,该选项不正确。故本题选AC。
点评:本题考查阿伏伽德罗常数的应用,较为基础,可根据所学知识进行解答。
本题难度:简单
5、选择题 NA代表阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,14 g N2含有的分子数为0.5NA
B.6.72L NO2与足量H2O反应,转移的电子数为0.1NA
C.0.1mol/L的NaOH溶液中含钠离子数为0.1NA
D.0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4NA
参考答案:A
本题解析:
正确答案:A
A.正确,常温常压下,14 g N2为0.5mol,含有的分子数为0.5NA
B.不正确,不知是否是标准状况;
C.不正确,0.1mol/L是浓度,缺少体积;
D.不正确,0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4mol
3Fe+4H2O=Fe3O4+4H2
本题难度:一般