1、选择题 SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质 (? )
A.立刻褪色
B.慢慢褪色
C.先褪色,后复原
D.颜色不褪
参考答案:D
本题解析:氯气具有氧化性,能把SO2氧化生成硫酸和盐酸,反应的化学方程式是SO2+Cl2+2H2O=H2SO4+2HCl,所以如果将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质不褪色,答案选D。2的漂白
点评:该题是基础性试题的考查,试题注重经常,侧重能力的培养,有助于培养学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
2、选择题 下列说法中不正确的是(?)?
A.氯气、液氯和氯水是同一种物质
B.工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定
C.从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤,氧化剂一般选择氯气
D.铵态氮肥不能与草木灰混合施用
参考答案:A
本题解析:A.氯气、液氯是同一种物质,氯水是氯气溶于水所得溶液是氯水混合物。
点评:考查元素化合物的基本知识。
本题难度:简单
3、选择题 关于酸、碱、盐的定义,下列各种说法中正确的是
A.化合物电离出的阳离子有氢离子的就是酸
B.化合物电离出的阴离子有氢氧根离子的就是碱
C.盐电离出的阳离子不一定都是金属阳离子
D.NH4Cl电离的电离方程式是NH4Cl====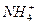 +Cl-,NH4Cl属于盐
+Cl-,NH4Cl属于盐
参考答案:CD
本题解析:酸的定义为电离时生成的阳离子全部是氢离子的化合物。碱的定义为电离时生成的阴离子全部是氢氧根离子的化合物。要注意A、B没有“全部”二字,都是不正确的。盐电离时生成的阳离子一般为金属离子,也可以是铵根离子(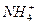 ),这样的盐称为铵盐。
),这样的盐称为铵盐。
本题难度:简单
4、选择题 50 g含有1.17 g氯化钠和0.84 g氟化钠的溶液中加入过量的硝酸银溶液,充分反应后搅拌、静置、过滤、洗涤、干燥得到2.87 g固体,由此可得出的结论是(? )
A.氯离子只有一部分参加反应
B.氟离子只有一部分参加反应
C.氟化银难溶于水
D.氟化钠和硝酸银在溶液中无沉淀生成
参考答案:D
本题解析:n(NaCl)=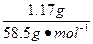 ="0.02" mol,根据反应NaCl+AgNO3====AgCl↓+NaNO3可得0.02 mol AgCl,m(AgCl)="0.02" mol×143.5 g·mol-1="2.87" g。由于AgNO3过量,NaCl可全部反应。若AgF不溶于水,则沉淀的质量必大于2.87 g,所以氟离子不参加反应。
="0.02" mol,根据反应NaCl+AgNO3====AgCl↓+NaNO3可得0.02 mol AgCl,m(AgCl)="0.02" mol×143.5 g·mol-1="2.87" g。由于AgNO3过量,NaCl可全部反应。若AgF不溶于水,则沉淀的质量必大于2.87 g,所以氟离子不参加反应。
本题难度:简单
5、选择题 甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-、I-)离子。向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有(? )
A.Br-、Cl-、I-
B.I-、Br-、Cl-
C.Br-、I-、Cl-
D.Cl-、I-、Br-
参考答案:C
本题解析:向甲中加淀粉溶液和氯水,则溶液变为橙色,发生Cl2+2Br-=Br2+2Cl-,则甲中含有溴离子;再加入丙溶液,颜色无明显变化,因氯气能氧化碘离子,则丙中不含碘离子,即丙中含氯离子,甲、乙、丙三种溶液各含有一种离子,则乙中含碘离子,所以甲、乙、丙依次含有Br-、I-、Cl-。
本题难度:一般