1、选择题 下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成(1)(2)两题。

(1)下列叙述正确的是
[? ]
A.装置I在反应过程中自始至终只生成红棕色气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置I在反应结束时溶液中的金属阳离子只有Cu2+
(2)下列与反应原理相关的叙述不正确的是
[? ]
A.装置I中不可能发生如下反应:Fe+2Fe3+=3Fe2+
B.装置Ⅱ在反应结束时溶液中存在Fe2+
C.装置工的溶液若换为稀硝酸,则腐蚀过程与原装置不同
D.装置Ⅱ中的铁丝能发生电化学腐蚀
参考答案:(1)C
(2)A
本题解析:
本题难度:一般
2、选择题 将下图所示实验装置的K闭合,下列判断错误的是
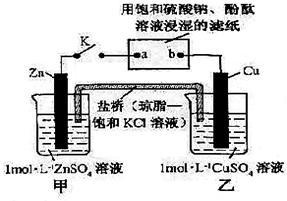
A.盐桥中的K+移向乙池
B.电子沿Zn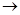 a
a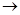 b
b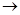 Cu路径流动
Cu路径流动
C.b电极上的反应式为4OH-—4e-=O2↑+2H2O
D.片刻后可观察到滤纸a点变红色
参考答案:B
本题解析:将装置中K闭合,该装置构成原电池,其中甲池中Zn是负极,电极上发生氧化反应,乙池中Cu是正极,发生还原反应,依次来判断;A、原电池中阳离子向正极移动,即向乙池移动,正确;B、电子沿Zn→a,在a、b上是溶液中的离子放电,电子不能直接由a→b,错误;C、硫酸钠润湿的滤纸是电解池,b是阳极,OH-放电发生氧化反应4OH-—4e-=O2↑+2H2O,正确;D、在a处是阴极,溶液中的H+ 得到电子,c(H+) 减小,c(OH-)增大,a处滤纸变红色,正确。
本题难度:一般
3、实验题 某课外活动小组同学用如图Ⅰ装置进行实验,试回答下列问题。
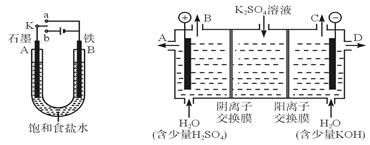
图I?图II
(1)若开始时开关K与a连接,则B极的电极反应式为_____________。
(2)若开始时开关K与b连接,则总反应的离子方程式为_______?______;
有关上述实验,下列说法正确的是(填序号)_____________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模仿工业上用离子交换膜法制烧碱的方法,设想用如图Ⅱ装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽工作时,通过阴离子交换膜的离子数_______(填“大于” “小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_____? ________。
(4)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为?。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为?kg。
参考答案:(1)Fe-2e—=Fe2+? (2)2Cl— + 2H2O="==" H2↑ + Cl2↑ + 2OH—? BD
(3) 小于?由于氢离子在阴极放电,促进了水的电离,导致溶液中OH-浓度增大(3分)
(4)SiCl4+2H2+O2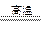 SiO2+4HCl? 0.522
SiO2+4HCl? 0.522
本题解析:略
本题难度:一般
4、选择题 为防止海轮船体的腐蚀,应在船体水线以下位置嵌上一定数量的( )?
A.铜块
B.铅块?
C.锌块
D.钠块
参考答案:C
本题解析:为防止海轮船体的腐蚀,所以应镶嵌金属性比铁强的做负极,达到保护铁的目的,而D钠块与水反应,所以答案选C。
本题难度:简单
5、简答题 (Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)______.
(Ⅱ)据报道,全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
(1)请你根据不同原理,提出防止钢铁锈蚀的两条合理措施:
①______;②______.
(2)请写出用稀硫酸除去铁锈的化学反应方程式:______.
(3)向含有铬离子(Cr3+)的废水中加入石灰乳[Ca(OH)2],降低溶液的酸度.当调节废水的PH至8~9时,铬离子形成Cr(OH)3沉淀而分离,其反应的离子方程式是:______.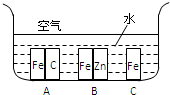
参考答案:(Ⅰ)铁处于A的环境中做原电池的负极,腐蚀速率较快,铁处于B的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于C的环境中的金属铁发生吸氧腐蚀,速度较慢,
故答案为:A>C>B;
(Ⅱ)防止钢铁锈蚀关键是与氧气和水隔绝,可以进行表面防护处理(涂油、刷漆、表面镀金属等),还可以改变金属内部结构(制成不锈钢)等,
故答案为:改变金属内部结构(制成不锈钢);刷漆(涂油、表面镀金属);
(2)铁锈的主要成分是氧化铁,可以和酸反应生成盐和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)根据信息提示:铬离子(Cr3+)在pH至8~9时的溶液中,会形成Cr(OH)3沉淀,则和氢氧化钙的反应为:2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+,
故答案为:2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+.
本题解析:
本题难度:一般