1、填空题 (11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
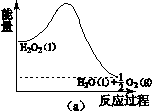
试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:
 Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ="="
_________ ="="  _________+
_________+  _________
_________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。

(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
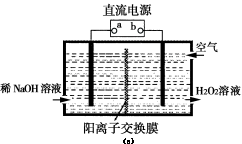
试回答:
①电源a极的名称是 。
②写出阴极电极反应式 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
参考答案:(11分)
(1) (1分)
(1分)
(2)放热 (1分)
①2 1 2H+ 2 Fe3+ 2H2O (2分)
②深 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动(2分)
(3)①正极 (1分)
②O2+2e-+2H2O=H2O2+2OH- (1分)
(4)H2O2+2H++Cu=Cu2++2H2O (1分)
温度升高H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低 (2分)
本题解析:(1)H2O2为共价化合物,电子式为 ;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g)
;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g)  N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。
N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。
考点:反应热、离子方程式、化学平衡、电化学
本题难度:困难
2、填空题 (共13分)I(7分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
II(6分)燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。
(4)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,其电池反应为4NH3+3O2=2N2+6H2O
写出该燃料电池的正极反应式
(5)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
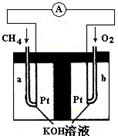
①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
参考答案:(1)负;4Al2Cl7— + 3e— =" Al" + 7AlCl4—;H2 (2) 3
(3)b、d;不能;Fe2O3+6H+ = 2Fe3+ + 3H2O Fe + 2Fe3+ = 3Fe2+
(4)O2 + 2H2O+ 4e— = 4OH—
(5)①CH4-8e—+10OH—= CO32—+7H2O ②c(K+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+)
本题解析:(1)根据电解原理知,在钢制品上电镀铝,钢制品为镀件,作阴极,连接电源的负极;电镀铝阴极应生成单质铝,所以阴极电极反应式为:4 Al2Cl7—+3e?=Al+7 AlCl4—;若改用AlCl3水溶液作电解液,H2O电离产生的H+放电生成H2;(2)用NaOH溶液溶解钢制品表面的铝镀层的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑还原产物为H2,与转移电子的对应关系为:H2 ~ 2e?,n(H2)=1/2n(e?)=1/2×6mol=3mol;(3)铝热反应需要用Mg和KClO3提供高温条件,选b、d;H2SO4与Fe2O3反应可生成Fe3+,但铝热反应生成的Fe可将Fe3+还原为Fe2+,发生反应:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,加入KSCN,无明显现象;(4)NH3燃料电池,其电池反应为 4NH3+3O2=2N2+6H2O,该燃料电池的正极反应式O2 + 2H2O+ 4e— = 4OH—;(5)①碱性甲烷燃料电池放电时,甲烷在负极失电子,生成碳酸根,利用电荷守恒和原子守恒配平,电极反应式为:CH4-8e—+10OH—= CO32—+7H2O;②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL,物质的量为0.4mol,转移的电子为0.16mol,利用电子守恒知参加反应的甲烷为0.02mol,生成的二氧化碳为0.02mol,与100.0 mL 3.0 mol·L—1 KOH溶液反应后电解质溶液为等浓度的碳酸钾和碳酸氢钾的混合液,各离子浓度的大小关系为:c(K+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+)。
考点:考查电化学原理、氧化还原反应原理、铝热反应、离子浓度大小比较。
本题难度:困难
3、计算题 (7分)在25 ℃时,用石墨电极电解1000mL一定浓度的CuSO4溶液。5 min后电解完全,在一个石墨电极上只有1.28 g Cu生成。试回答下列问题:
(1)电解总离子方程式反应式为?。
(2)得到的溶液的pH是??。(lg2=0.3)反应速率v(Cu2+):v(O2)=?
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为?
(KspCu(OH)2=2×10-20)
参考答案:(1)2Cu2++2H2O=2Cu+O2+4H+(2分)(2)1.4;(1分) 2:1?(1分)(3)5(2分)
本题解析:(2)2Cu2++2H2O=2Cu+O2+4H+,由铜求出4H+为:0.04 mol;则c(H+)="0.04" mol/L,pH=1.4
根据公式可知: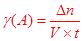 ,两者的速度比为2:1
,两者的速度比为2:1
(3)原溶液中c(Cu2+)="0.02" mol/L,由KspCu(OH)2=2×10-20=c(Cu2+)×c2(OH—)可求出c(OH—)=10—9mol/L,则c(H+)=10—5mol/L,pH=5
本题难度:一般
4、选择题 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有 Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用如图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体y mL。
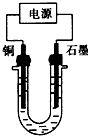
下列说法正确的是
[? ]
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是
参考答案:C
本题解析:
本题难度:一般
5、选择题 下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。符合这一情况的是表中的

参考答案:A
本题解析:通电后发现a极板质量增加,说明金属阳离子在a极得电子,a极是阴极,B项是用惰性电极电解NaOH溶液,阴极氢离子得电子生成氢气,B项错误;C.a极与电源的负极相连,X为负极,C项错误;D. 电解CuCl2溶液,阳极产生黄绿色的气体,而实际上b极是阳极,b极板处有无色无臭气体放出,D项错误;选A。
考点:考查电解池的工作原理。
本题难度:一般