1、选择题 假如12C相对原子质量为24,以0.024千克12C所含12C的原子数为阿伏加德罗常数。下列数值肯定不变的是(?)
A.阿伏加德罗常数
B.气体摩尔体积
C.一定质量气体的体积
D.O2的相对分子质量
参考答案:C
本题解析:略
本题难度:简单
2、选择题 NA表示阿伏加德罗常数值。下列说法正确的是
A.1mol Na2O2与足量CO2充分反应转移的电子数为2NA
B.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
C.向FeI2溶液中通入适量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目为NA
D.t℃时,1L pH=6的纯水中,含1×10—6 NA个OH—
参考答案:D
本题解析:过氧化钠中氧元素由—1价变为0价和—2价,化合价升降总数等于转移电子数,则2Na2O2+2CO2=2Na2CO3+O2~2e—,由于过氧化钠与转移电子的系数之比等于物质的量之比,则2mol过氧化钠与足量二氧化碳充分反应转移2mol电子,所以1mol过氧化钠与足量二氧化碳充分反应转移1mol电子,故A选项错误;由于c(H+)=10—pHmol/L,则pH=1的醋酸溶液中氢离子浓度为0.1mol//L,由于醋酸是部分电离出氢离子的弱酸,则醋酸的浓度大于0.1mol/L,由于n=c?V,缺少溶液的体积或溶液体积不一定是1L,则醋酸分子的物质的量不一定大于0.1mol,故B选项错误;由于碘离子的还原性大于亚铁离子,FeI2=Fe2++2I—中碘离子与亚铁离子的系数之比等于物质的量之比,当1mol Fe2+被氧化Fe3+为时,2molI—也会被氧化为I2,即Fe2++2I—+3/2Cl2=Fe3++3Cl—+I2~3e—,由于转移电子与亚铁离子的系数之比等于物质的量之比,则1mol Fe2+被氧化时,总共转移3mol电子,故C选项错误;由于c(H+)=10—pHmol/L,则pH=6的纯水中氢离子浓度为10—6 mol//L,由于n=c?V,则1L纯水中水电离出的氢离子的物质的量为10—6 mol,由于H2O H++OH—中氢氧根离子与氢离子的系数之比等于物质的量之比,则1L纯水中的氢氧根离子的物质的量为10—6 mol,故D选项正确。
H++OH—中氢氧根离子与氢离子的系数之比等于物质的量之比,则1L纯水中的氢氧根离子的物质的量为10—6 mol,故D选项正确。
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数,下列说法正确的是:
A.8.2 g Na218O2与过量的H216O作用,生成的氧气中含有的中子数为0.8 NA
B.标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5 NA
C.0.4 mol乙炔和乙醛混合气体在氧气中充分燃烧,消耗氧气的分子数为NA
D.200 mL 1 mol·L-1 Fe2(SO4)3溶液中,Fe3+ 和SO42-离子数的总和是NA
参考答案:C
本题解析:A:2molNa218O2中的两个18O自身得失1mol电子,生成的氧气为1mol18O2,故8.2 g Na218O2的物质的量为0.1mol,生成的氧气为0.05mol,其中的中子数为NA个,不正确
B:标准状况下,氯仿非气态,不适用于气体的摩尔体积,不正确
C:乙炔、乙醛两者完全燃烧时与氧气的物质的量之比均为2:5,故消耗的氧气的分子数为NA,正确
D:由于Fe3+的水解:Fe3++3H2O Fe(OH)3+3H+,故Fe3+ 和SO42-离子数的总和大于NA,不正确
Fe(OH)3+3H+,故Fe3+ 和SO42-离子数的总和大于NA,不正确
答案为C
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.46gNO2和N2O4的混合物中含有的原子总数一定是3NA
B.500℃、30MPa下:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
2NH3(g)△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
C.标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
D.1 mol SiO2晶体中,Si-O键的数目为2NA
参考答案:A
本题解析:A:混合物中N与O元素的个数比为1:2,也就是说46克混合物中一定有1molN原子和2molH原子,共3mol,正确
B:可逆反应不可能进行到底,故放出的热量小于19.3kJ
C:反应中氯气发生了自身氧化还原反应,1mol氯气参加反应转移1mol电子,故该反应中转移的电子数为0.5NA
D:1 mol SiO2晶体中,Si-O键的数目为4NA
答案为A
本题难度:一般
5、选择题 标准状况下,a L气体X2和b L气体Y2恰好完全反应生成c L气体Z,若Z的化学式为X3Y,则a,b,c的关系为(?)
A.2a="3b=6c"
B.
C.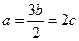
D.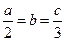
参考答案:B
本题解析:略
本题难度:一般