1、填空题 (12分)有A、B、C、D、E5种元素,已知:
①A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
②常温下B2是气体,相同条件下,它的密度是氢气的16倍。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1)D是?,其在周期表中的位置为??。
(2)E的原子结构示意图为?,C的离子结构示意图为?。
(3)F和AB2反应的化学方程式为?。
(4)F中含有的化学键为?。
参考答案:(1)S?第三周期VIA族(2)略?(3)略
(4)离子键、共价键
本题解析:略
本题难度:简单
2、填空题 (12分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:根据元素的结构和有关性质可知,A、B、C、D、E、F分别是H、C、O、Na、Al、S。
(1)F元素在周期表中的位置为?,B的最高价氧化物电子式为?,E元素的价层电子排布式为?。
(2)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为?。
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式?;
(4)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为?。
参考答案:(1)第三周期第ⅥA族?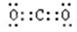 ?3s23p1?
?3s23p1?
(2)2A+8OH--6e-=2AlO2-+4H2O
(3)C(s)+1/2O2(g)=CO(g)? H=-(a-2b)kJ/mol?(4)8mol
本题解析:根据元素的结构和有关性质可知,A、B、C、D、E、F分别是H、C、O、Na、Al、S。
(1)S位于第三周期第ⅥA族;CO2中含有极性键,电子式为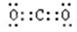 ;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。
;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。
(2)铝能和氢氧化钠溶液反应,所以负极是铝,方程式为2A+8OH--6e-=2AlO2-+4H2O。
(3)碳的燃烧热为a kJ/mol,则①C(s)+O2(g)=CO2(g)? H=-akJ/mol;14gCO完全燃烧放出热量b kJ,所以有②CO(g)+1/2O2(g)=CO2(g)? H=-2bkJ/mol。则根据盖斯定律可知①-②即得到C(s)+1/2O2(g)=CO(g)? H=-(a-2b)kJ/mol。
(4)Al2S3和氢氧化钠反应的反应式为Al2S3+8NaOH=2NaAlO2+3Na2S+4H2O,所以消耗氢氧化钠是8mol。
本题难度:一般
3、计算题 某元素的同位素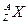 ,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
参考答案:
(1) =20,
=20, =40。(2)第四周期,ⅡA族。(3)有气泡产生。Ca+2H2O
=40。(2)第四周期,ⅡA族。(3)有气泡产生。Ca+2H2O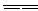 Ca(OH)2+H2↑。
Ca(OH)2+H2↑。
本题解析:
Ag++Cl-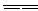 AgCl
AgCl
1 1?
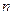 ?(Ag+)="1" mol·L-1×0.02 L
?(Ag+)="1" mol·L-1×0.02 L
所以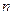 (Cl-)=" 0.02" mol
(Cl-)=" 0.02" mol
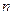 (XCl2)=" 0.01" mol
(XCl2)=" 0.01" mol
 (XCl2)=" 111" g·mol-1
(XCl2)=" 111" g·mol-1
 (X)= 111-71=40
(X)= 111-71=40
则 =40,
=40, =20,该元素是Ca
=20,该元素是Ca
本题难度:一般
4、选择题 全部由第二周期元素形成的化合物是
A.CO2
B.H2O
C.Na2O
D.MgCl2
参考答案:A
本题解析:略
本题难度:简单
5、选择题 基态氧原子核外电子的运动状态有
A.3种
B.2种
C.8种
D.1种
参考答案:C
本题解析:氧原子核外有8个电子,每个电子运动状态都不相同。
本题难度:一般