1、选择题 设NA为阿伏加德罗常数的值,下列叙述不正确的是
A.36g镁在足量的氮气中完全燃烧共转移的电子数为3NA
B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢键数目为3NA
C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
D.1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
参考答案:C
本题解析:A.转移的电子数为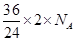 =3NA,正确
=3NA,正确
B.对于单烯烃来讲,每14g(一个原子团CH2)就有两个C—H键,正确
C.由于发生以下两反应:2NO+O2=2NO2? 2NO2 N2O4,可见,最终混合后气体中分子总数小于2NA,不正确
N2O4,可见,最终混合后气体中分子总数小于2NA,不正确
D.两物质中阴、阳离子的个数比均为2:1,正确
答案为C
本题难度:一般
2、计算题 某含(NH4)2SO4和K2SO4的混合溶液100mL,向其中滴加足量的Ba(OH)2溶液,加热,充分反应,生成的气体在标准状况下体积为448 mL,将反应后的溶液过滤得白色沉淀4.66 g。求原混合溶液中K2SO4的物质的量浓度。
参考答案:(NH4)2SO4?+Ba(OH)2======BaSO4↓+ 2NH3↑ + 2H2O
233g? 2×22.4L
mg? 0.448L? m=2.33g
K2SO4? + Ba(OH)2 ="====" BaSO4↓ + 2KOH
1mol? 233g
n mol? 4.66g-2.33g? n=0.01mol
c=0.01mol/0.1L=0.1mol/L
本题解析:略
本题难度:简单
3、简答题 已知CO和O2的混合气体14.4g,在一定条件下完全反应,得到CO和CO2的混合气体,在标准状况下所占的体积为8.96L.则反应后混合气体的平均摩尔质量为______,产物中CO2的物质的量为______mol,原混合气体中,O2的物质的量为______.
参考答案:n(CO和CO2)为8.96L22.4L/mol=0.4mol,m(CO和CO2)=m(CO和O2)=14.4g,混合气体的平均摩尔质量为14.4g0.4mol=36g/mol;
设混合气体中CO的物质的量为xmol,O2的物质的量为ymol,则
? 2CO+O2 =2CO2
?2ymol?ymol?2ymol
所以CO和CO2的物质的量分别为(x-2y)mol、2ymol;
? 28x+32y=14.4g
? x-2y+2y=0.4
解之得:x=0.4,y=0.1,即产物中CO2的物质的量为0.2mol,O2的物质的量0.1?mol,
故答案为:36g/mol;0.2mol;0.1mol.
本题解析:
本题难度:一般
4、选择题 将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A.66.4 g
B.50.8 g
C.44.8g
D.39.2g
参考答案:B
本题解析:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L(标准状况),所以金属铝的质量是5.4g,金属铝失电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共失去电子的物质的量为 ×3=1.8mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,反应中金属铁、铜失去电子的物质的量1.2mol等于生成碱的氢氧根离子的物质的量,即n(OH-)=1.2mol,所以反应后沉淀的质量等于35.8g-5.4g+1.2mol×17g·mol-1=50.8 g.故选B.
×3=1.8mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,反应中金属铁、铜失去电子的物质的量1.2mol等于生成碱的氢氧根离子的物质的量,即n(OH-)=1.2mol,所以反应后沉淀的质量等于35.8g-5.4g+1.2mol×17g·mol-1=50.8 g.故选B.
本题难度:一般
5、选择题 用质量分数为ω的浓盐酸(其密度为ρ1g﹒cm-3),按浓盐酸与水的体积比为1﹕3配制成稀盐酸(其密度为ρ2g﹒cm-3),则所配制稀盐酸的物质的量浓度为( )
A.
mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:令浓盐酸的体积为1L,则水的体积为3L.
所以氯化氢的质量为1000mL×ρ1g﹒cm-3×ω=1000ρ1ωg
混合后稀盐酸的质量为1000mL×ρ1g﹒cm-3×+3000mL×1g/mL=(3000+1000ρ1)g.
所以混合后稀盐酸中氯化氢的质量分数为1000ρ1ωg(3000+1000ρ1)g
所以稀盐酸的物质的量浓度为c=1000×ρ2×1000ρ1ω(3000+1000ρ1)g36.5=1000ρ1ρ2ω36.5(ρ1+3)mol/L.
故选C.
本题解析:
本题难度:一般