| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学基本概念》考点强化练习(2019年押题版)(二)
参考答案:B 本题解析:氧化还原反应的特征是有化合价的变化,有化合价变化的反应是氧化还原反应,A、有元素化合价发生变化,是氧化还原反应,是分解反应,A不选;B、没有元素化合价发生变化,不是氧化还原反应,是复分解反应,B选;C、钠元素化合价发生变化,是氧化还原反应,C不选;D、有元素化合价发生变化,是氧化还原反应,D不选;选B。 本题难度:一般 2、选择题 将1. 12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是 ( ) |
参考答案:B
本题解析: n(Fe)=0.02 mol,n(Fe3+)=0.025 L×2 mol·L-1=0.05 mol,由反应2Fe3++Fe====3Fe2+可知Fe3+过量,加入KSCN显红色;溶液中n(Fe2+)=3n(Fe)=0.06 mol,溶液中n(Fe3+)=0.05 mol-2n(Fe)=0.01 mol,即Fe2+和Fe3+的物质的量之比为6∶1,氧化产物与还原产物的物质的量之比为1∶2。
考点:铁、铜及其化合物的应用
本题难度:一般
3、选择题 在pH=0和pH=14的溶液中,都能大量共存的离子组是
A.Cu2+、Na+、Mg2+、NO3-
B.K+、Cl-、I-、SO42-
C.S2O32-、Na+、K+、AlO2-
D.NO3-、H2PO4-、NH4+、Ag+
参考答案:B
本题解析:A中Cu2+、Mg2+在pH=14的碱性溶液中不能大量共存;C中S2O32-、AlO2- 在pH=0的酸性溶液中不能大量共存;D中H2PO4-、NH4+、Ag+在pH=14的碱性溶液中不能大量共存,H2PO4-在pH=0的酸性溶液中也不能大量共存。
本题难度:困难
4、选择题 氧化还原反应与四种基本类型反应的关系如下图,则下列化学反应属于区域3的是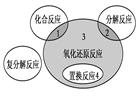
A.2H2+O2点燃2H2O
B.2NaHCO3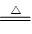 Na2CO3+H2O +CO2↑
Na2CO3+H2O +CO2↑
C.CuO+CO 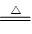 Cu + CO2
Cu + CO2
D.Zn +H2SO4 = ZnSO4 + H2↑
参考答案:C
本题解析:区域3为既属于氧化还原反应,又不属于置换反应,也不属于化合反应,更不属于分解反应,符号要求的只有C,所以C正确。
考点:考察氧化还原反应与四种基本反应类型的关系。
本题难度:一般
5、选择题 某反应体系中存在下列六种物质:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反应物之一。下列说法不正确的是
A.该反应属于氧化还原反应
B.此反应中只有砷元素被氧化,只有氮元素被还原
C.HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物
D.HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物
参考答案:B
本题解析:根据“As2S3是反应物之一”,说明是H3AsO4、H2SO4生成物,反应前后As、S元素的化合价升高,进一步说明“HNO3是反应物,NO是生成物(反应前后N元素的化合价降低)”,从而判断B项错误。
考点:考查氧化还原反应原理。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《溶液的酸碱.. | |