1、选择题 某元素的气态氢化物的化学式为XH3,其中X的质量分数约为82.4%,则X在周期表中的位置是
A.第二周期VA
B.第二周期VⅡA
C.第三周期VA
D.第三周期VⅡA
参考答案:A
本题解析:由气态氢化物的化学式为XH3,X的质量分数约为82.4%,可求得X的相对原子质量为14,即X元素为N元素,位于周期表中第二周期VA;
本题难度:简单
2、填空题 在元素周期表中
小题1:周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族;
小题2: 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
小题3:同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
小题4: 同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。
参考答案:
小题1: 18 15 ⅢB ⅢB
小题2:减小 减弱
小题3: 增大 增强
小题4: 大于 小
本题解析:小题1: 18 15 ⅢB ⅢB
小题2:减小 减弱
小题3: 增大 增强
小题4: 大于 小
本题难度:简单
3、填空题 (4分)用元素符号填空:
(1)原子半径最小的元素是________。
 (2)第一电离能最大的元素是________。
(2)第一电离能最大的元素是________。
(3)电负性最大的元素是________。
(4)第四周期中,第一电离能最小的元素是________。
参考答案:H? He F? K
本题解析:略
本题难度:一般
4、填空题 短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
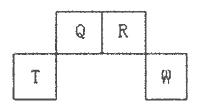
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为?(用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
参考答案:(1)第三周期ⅥA族;Al>C>N;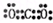 ;
;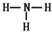 ;(2)弱于;(3)低;(4)金刚石;(5)⑦;⑥。
;(2)弱于;(3)低;(4)金刚石;(5)⑦;⑥。
本题解析:短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素;(1)W为S元素,原子核外有3个电子层,最外层电子数为6,处于周期表中第三周期ⅥA族;同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>C>N;Q的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对,其电子式为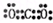 ;R气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其结构式为
;R气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其结构式为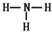 ,故答案为:第三周期ⅥA族;Al>C>N;
,故答案为:第三周期ⅥA族;Al>C>N;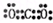 ;
;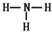 ;(2)非金属性S>C,故的电子能力S>C,故答案为:弱于;
;(2)非金属性S>C,故的电子能力S>C,故答案为:弱于;
(3)原子序数比R多8的元素形成的一种常见气态氢化物为PH3,PH3分子之间为范德华力,NH3分子之间存在氢键,最大分子间作用力,故PH3沸点低于NH3,故答案为:低;(4)四元素单质中属于原子晶体的是金刚石,故答案为:金刚石;(5)R为氮元素,最高化合价为+5、最大化合价为-3,原子半径小于P,故为⑦号元素;与Al同周期且最高价氧化物的水化物碱性最强的元素为Na,最后化合价为+1,短周期中原子半径最大,故为⑥号元素,故答案为:⑦;⑥。
本题难度:一般
5、填空题 (8分)A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族,两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子,则B的原子结构示意图为______;A离子的结构示意图为_____;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 ,它的电子式是 ,它属于 化合物。
参考答案: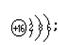 ;
;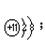 ; H2S,
; H2S,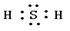 共价; Na2S ,
共价; Na2S ,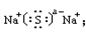 ? 离子 。
? 离子 。
本题解析:考查原子核外电子的排布规律、元素周期表的结构以及化学键的判断。B原子核外第3电子层比第2电子层少两个电子,则B是硫元素,所以A是钠元素,C就是氢元素。硫和氢形成的化学键是极性键,化合物是共价化合物。钠是活泼的金属,和硫形成离子键,化合物是离子化合物。
本题难度:一般