1、选择题 某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Na+、Ba2、NO3-、HCO3-
B.Cl-、Mg2+、H+、Na+、SO42-
C.MnO4-、K+、Cl-、Mn2+
D.Fe2+、NO3-、SO42-、OH-、Na+
参考答案:A.无论溶液呈酸性还是碱性,HCO3-都不能大量共存,故A错误;
B.如溶液呈酸性,可离子之间不发生任何反应,可大量共存,故B正确;
C.MnO4-有颜色,不能大量共存,故C错误;
D.Fe2+有颜色,不能大量共存,故D错误.
故选B.
本题解析:
本题难度:一般
2、填空题 (每空2分,共12分)有一瓶澄清溶液,其中可能含NH4+、K+、Mg2+、Ba2+、Al3+、SO42-、CO32-中的一种或几种,取该溶液进行如下实验。
①取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中,溶液中先产生白色沉淀后沉淀部分溶解;
②将步骤①得到的碱性溶液加热,用湿润的红色石蕊试纸检验,试纸不变蓝。
③另取少量原溶液,加BaCl2溶液,有白色沉淀生成,加入盐酸,沉淀不溶解。
根据上述实验事实确定并回答:
(1)上述溶液中肯定存在的离子有?,不能确定是否存在的离子有?,为确认是否含有该离子,应做?实验。
(2)写出步骤①中发生反应的离子方程式?、?、?。
参考答案:(每空2分,共12分)?(1)? Mg2+、Al3+、SO42-?;? K+ ;?焰色反应
(2)? Mg2+ +2OH-=Mg(OH)2↓? Al3+ +3OH-=Al(OH)3↓? Al(OH)3+OH-=AlO2-+2H2O
本题解析:溶液显酸性,因此没有CO32-。先产生白色沉淀后沉淀部分溶解,说明含有铝离子和镁离子。根据②可知,没有产生氨气,因此没有NH4+。根据③可知含有SO42-,则一定没有Ba2+。所以溶液中肯定存在的离子有Mg2+、Al3+、SO42-;
本题难度:一般
3、填空题 已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液?(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是?(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)="0.05" mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)?ΔH>0
Ca2+(aq)+A2-(aq)?ΔH>0
①温度升高时,Ksp?(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)?。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:?。
参考答案:(1)酸碱性无法确定? (2)B、C? (3)①增大?②增大
(4)CaA(s)+Cu2+(aq) Ca2+(aq)+CuA(s)
Ca2+(aq)+CuA(s)
本题解析:(1)HA-是弱酸的酸式酸根离子,既水解又电离,所以酸碱性无法确定。
(2)温度不确定,所以KW不确定,c(H+)·c(OH-)不一定等于1×10-14,A错;B项遵循电荷守恒,正确;因为加入KOH溶液使混合溶液中c(H+)=c(OH-),可知NaHA溶液显弱酸性,所以当溶液显中性时,滴入的KOH溶液的量小于NaHA溶液的量,故c(Na+)>c(K+),C项正确;混合溶液中c(Na+)+c(K+)>0.05 mol/L,D项错误。
(3)Ksp=c(Ca2+)×c(A2-),该过程是吸热过程,升温平衡向右移动,所以Ksp增大;滴加少量浓盐酸,A2-与H+结合,使平衡向右移动,所以c(Ca2+)增大。
(4)沉淀转化为更难溶的沉淀:CaA(s)+Cu2+(aq) Ca2+(aq)+CuA(s)。
Ca2+(aq)+CuA(s)。
本题难度:一般
4、选择题 下列各组中的离子能在溶液中大量共存的是( )
A.Na+、Ba2+、Cl-、CO32-
B.K+、H+、NO3-、HCO3-
C.Mg2+、H+、SO42-、NO3-
D.Na+、H+、Cl-、SiO32-
参考答案:A.Ba2+、CO32-结合生成沉淀,不能大量共存,故A错误;
B.H+、HCO3-结合生成水和气体,则不能大量共存,故B错误;
C.该组离子之间不反应,能大量共存,故C正确;
D.H+、SiO32-结合生成沉淀,不能大量共存,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 在下列给定的溶液中,一定能大量共存的离子组是(?)
A.过量Al与NaOH溶液反应所得溶液中:K+、Cl-、Al3+、SO42-
B.常温下,OH-的浓度为10-11mol/L的溶液中:Na+、I-、NH4+、NO3-
C.常温下,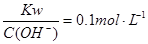 的溶液中:K+、NH4+、Cl-、SO42-
的溶液中:K+、NH4+、Cl-、SO42-
D.与Al反应产生H2的溶液中:K+、Na+、I-、NO3-
参考答案:C
本题解析:A项:Al与NaOH溶液反应生成的AlO2-离子会和Al3+发生双水解,故不能共存;B项:OH-的浓度为10-11mol/L的溶液呈酸性,在酸性条件下,NO3-有很强的氧化性,能氧化I-,故不能共存;D项:与Al反应产生H2的溶液既可以呈酸性又可以呈碱性,在酸性条件下,NO3-有很强的氧化性,能氧化I-,故不能共存。故选C。
点评:本题考查离子的共存问题,熟悉离子的性质及发生的反应是解答本题的关键,难度不大。(1)离子间相互结合形成沉淀、气体、弱电解质、络离子时不能大量共存;离子间发生双水解反应、氧化还原反应时不能大量共存。(2)注意题目的限制条件。
本题难度:一般