1、填空题 (10分)如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
(1)对此反应及现象的描述正确的是?
A.此反应为放热反应
B.白烟的生成说明产生了氯化钠分子
C.反应中钠元素被氧化,氯元素被还原。
(2)写出该反应的方程式?
(3)用电子式表示氯化钠的形成过程?,
(4)检验有Cl-生成,请补充实验步骤(可填满也不可填满)
①倒转集气瓶,加适量蒸馏水
②取少量溶液于试管中。
③加试管中加入?。
④有?生成则证明有Cl-。
参考答案:(1)AC?(2)2Na+Cl2="=2NaCl" (点燃)
(3)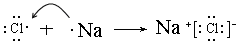
(4)硝酸银(或答硝酸酸化的硝酸银)、白色沉淀
本题解析:氯气具有强氧化性,钠是活泼的金属,二者化合生成氯化钠,属于放热反应。氧化钠是离子化合物,不是分子,其形成过程为 。B是错误的。答案选AC;检验氯离子一般用硝酸酸化的硝酸银,现象是产生白色沉淀。
。B是错误的。答案选AC;检验氯离子一般用硝酸酸化的硝酸银,现象是产生白色沉淀。
本题难度:简单
2、选择题 下列说法中,不正确的是( )
A.光照氯水时有气泡逸出,该气体是Cl2
B.燃煤时加入适量石灰石,可减少废气中SO2的量
C.NH3易液化,液氨常用作制冷剂
D.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
参考答案:A、氯水中含有次氯酸,次氯酸不稳定见光易分解生成氯化氢和氧气,所以逸出的气体是氧气,故A错误;
B、高温条件下,二氧化硫能和碳酸钙反应生成亚硫酸钙和二氧化碳,所以能减少二氧化硫的排放,故B正确;
C、氨很容易液化,液态氨汽化时要吸收大量的热,使周围物质的温度急剧下降,所以氨常作为制冷剂,故C正确;
D、普通玻璃属于硅酸盐产品,其主要成分是硅酸钠、硅酸钙和二氧化硅,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.0.1mol16O2和0.1mol18O2均含有0.8mol质子
B.K+、S2-的最外层电子数相同,化学性质相同
C.N2O5是酸性氧化物,能与NaOH溶液反应
D.新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色
参考答案:A、一个16O2或18O2分子中都含有16个质子,所以0.1mol16O2和0.1mol18O2均含有1.6mol质子,故A错误.
B、虽然K+、S2-的最外层电子数相同,但其化学性质不相同,故B错误.
C、五氧化二氮是酸性氧化物,能和水反应生成硝酸,硝酸能和氢氧化钠反应生成盐和水,所以N2O5能与NaOH溶液反应,故C正确.
D、氯气和水反应生成盐酸和次氯酸,导致其水溶液呈酸性,次氯酸有强氧化性,能使有色物质褪色,所以向新制氯水中滴加少量紫色石蕊溶液,溶液先变红后褪色,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 对下列事实的解释正确的是( )
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应
C.向50mL18mol?L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
参考答案:A、氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,氯气无漂白性,故A错误;
B、氢氟酸和玻璃中的二氧化硅反应,用氢氟酸可以雕刻玻璃,故B正确;
C、浓硫酸随反应进行,浓度变稀后稀硫酸和铜不反应,向50mL18mol?L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量小于0.45mol,故C错误;
D、常温下铝、铁在浓硫酸,浓硝酸中发生钝化,发生的是氧化还原反应生成一薄层致密的氧化物薄膜阻止反应进行,故D错误,
故选B.
本题解析:
本题难度:简单
5、选择题 已知氯化溴(BrCl)能发生下列反应:nBrCl+2M=MCln+MBrn,BrCl+H2O=HBrO+HCl。下列推断正确的是(?)
A.与水反应时,BrCl是还原剂
B.与水反应时,BrCl是氧化剂
C.BrCl氧化性比Br2和Cl2都强
D.BrCl氧化性强于Br2弱于Cl2
参考答案:D
本题解析:本题是一道信息迁移题。解题时应充分利用类比的方法,既要注意卤素互化物与卤素的相似性,又要注意差异性,将信息正确迁移。卤素互化物BrCl性质虽与卤素单质相似,但它们的化合价不同,单质中卤素的化合价为零价,而BrCl中,Br为+1价,Cl为-1价。这是解本题的关键所在。
在BrCl中元素的化合价应是:Br为+1价,Cl为-1价。所以在nBrCl+2M=MCln+MBrn中,溴的价态降低,而M的价态升高,氯的化合价不变。在BrCl+H2O=HBrO+HCl中,各元素的化合价均没有变化。在BrCl中,溴显+1价,氧化性强于Br2。BrCl与H2O反应中,并未把Cl-氧化成Cl2,所以氧化性BrCl<Cl2。
本题难度:简单