1、选择题 a、b、c、d均为短周期元素,a的原子结构示意图为 ,元素b形成的单质可以与CO2发生置换反应,原子序数b < c < a,b与d形成的化合物的电子式为
,元素b形成的单质可以与CO2发生置换反应,原子序数b < c < a,b与d形成的化合物的电子式为 。下列比较中正确的是
。下列比较中正确的是
A.原子半径c < d
B.最高价氧化物对应的水化物的碱性b < c
C.四种元素在同一周期
D.气态氢化物的稳定性a < d
参考答案:D
本题解析:略
本题难度:简单
2、选择题 随着科学 技术的不断进步,研究物质的手段和途径越来越多,N
技术的不断进步,研究物质的手段和途径越来越多,N 、H3、O4、C60等已被发现。下列有关说法中,正确的是?(?)
、H3、O4、C60等已被发现。下列有关说法中,正确的是?(?)
A.N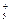 中含有36个电子
中含有36个电子
B.O2和O4属于同位素
C.C60晶体是原子晶体
D.H2和H3属于同素异形体
参考答案:D
本题解析:略
本题难度:简单
3、选择题 下表为短周期元素①~⑧的部分性质。
 元素编号 元素编号
元素性质
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径/10-10m
| 0.66
| 1.36
| 1.23
| 1.10
| 0.99
| 1.54
| 0.70
| 1.18
|
最高化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
| +3
|
最低化合价
| —2
| ?
| ?
| —3
| —1
| ?
| —3
| ?
|
下列说法正确的是?
A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
参考答案:
BC
本题解析:略
本题难度:一般
4、填空题 (8分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是?,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是?;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是?,(填氢化物化学式),原因是?;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水):?。
参考答案:(1) 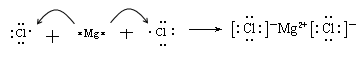
(2)? Al3+?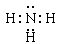 ?
?
(3)? HF? HF分子之间存在氢键?(4)Al(OH)3+3H+=Al3++3H2O
本题解析:标准状况下22.4L的H2的物质的量是1mol,反应中转移的电子是2mol,所以1molA在反应中失去2mol电子,即A离子的化合价是+2价。由于A离子和氖原子具有相同电子层结构,所以A的原子序数是12,即A是镁元素。则B是铝元素,C是氯元素。
(1)镁和氯属于活泼的金属和非金属,形成的化学键是离子键,电子式为
 。
。
(2)金属阳离子的电子式就是就是阳离子符合。Al3+是10电子微粒,在10电子微粒中能与盐酸化合生成盐的分子是氨气,电子式为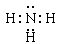 。
。
(3)F是最活泼的非金属元素,在HF中含有氢键,所以其沸点高。
(4)B最高价氧化物的水化物和C最高价氧化物的水化物分别是氢氧化铝和高氯酸,所以反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。
本题难度:一般
5、选择题 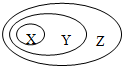 下表中所示物质或概念间的从属关系符合如图的是
下表中所示物质或概念间的从属关系符合如图的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:由图可知,概念的范畴为Z包含Y,Y包含X,然后利用物质的组成和性质来分析物质的类别,再根据概念的从属关系来解答.
解答:A、钠元素为主族元素,主族元素中一、二、三周期属于短周期元素,主族元素中四、五、六、七周期属于长周期元素,故A错误;
B、胶体属于分散系,而分散系都是由两种以上的物质组成,则属于混合物,故B错误;
C、电解质属于化合物,化合物都是纯净物,故C正确;
D、置换反应属于氧化还原反应,而氧化还原反应不一定是放热反应,故D错误;
故选:C.
点评:本题考查物质的组成和分类,学生应能识别常见物质的种类,并能利用其组成来判断物质的类别是解答的关键.
本题难度:简单