1、选择题 在密闭容器中充入4 mol X,在一定温度下4X(g)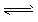 3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是
3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是
[? ]
A.4 mol
B.3.4 mol
C.2.8 mol
D.1.2 mol
参考答案:A
本题解析:
本题难度:一般
2、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)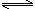 N2(g)+3H2(g)?△H=+92.4kJ/mol
N2(g)+3H2(g)?△H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质物质的量/mol
| 平衡时反应中的能量变化
|
NH3
| N2
| H2
|
①
| 2
| 0
| 0
| 吸收热量akJ
|
②
| 0
| 1
| 3
| 放出热量bkJ
|
③
| 4
| 0
| 0
| 吸收热量ckJ
|
?
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
参考答案:C
本题解析:A、反应①②平衡状态相同,但加入物质不同,热量关系为:a+b=92.4,错误;B、3个反应温度相同,所以平衡常数相等,错误;C、反应③加入的反应物是反应①的2倍,在等温等容的条件下,容器③的压强大,平衡向左移动,所以达平衡时H2的体积分数:①>③,正确;D、根据质量守恒定律,气体的质量不变,容器恒容,所以密度是一个定值,密度不变不能说明反应已达到平衡,错误。
本题难度:一般
3、计算题 在2 L密闭容器中,充入1 mol N2和3mol H2,恒温恒容条件下发生合成氨反应,2 min时达到平衡。测得平衡时N2的转化率为40%,求:
(1)用H2表示2min内该反应的平均反应速率
(2)NH3的平衡浓度
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强P平与起始时压强P始之比
参考答案:(1)N2(g)+3H2(g) 2NH3(g)
2NH3(g)
始 1 mol? ?3 mol? 0 mol
变 0.4 mol? 1.2 mol? 0.8 mol
平 0.6 mol? 1.8 mol? 0.8 mol
v(H2)=△C(H2/)△t=0.3 mol/(L·min)
(2)N2(g)+3H2(g)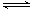 2NH3(g)
2NH3(g)
始 1 mol? ?3 mol? 0 mol
变 0.4 mol? 1.2 mol? 0.8 mol
平 0.6 mol? 1.8 mol? 0.8 mol
c(NH3)平=0.4 mol/L
(3)恒温恒容条件下,体积比等于物质的量之比,H2的体积分数= 1.8/(1.8+0.6+0.8 )=56.25%
(4)PV=nRT,恒温恒容时压强比等于物质的量之比,P平:P始=n平:n始=(1.8+0.6+0.8):(1+3)=4:5
本题解析:
本题难度:一般
4、选择题 在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) ?C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是:?(?)
?C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是:?(?)
A.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达到平衡时,途径I的和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径Ⅱ密度的1/2
参考答案:B
本题解析:根据反应的方程式可知,反应前后体积是不变的,A和B的物质的量之比相等,因此两容器中的平衡是等效的。所以选项B不正确,其余选项都是正确的,答案选B。
本题难度:一般
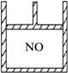
5、选择题 下图为装有活塞的密闭容器,内盛22.4 mL一氧化氮。若通入11.2 mL氧气(气体体积均在标准状况下测定)保持温度、压强不变,则容器内气体的密度(? )
A.等于1.369 g/L
B.等于2.054 g/L
C.在1.369 g/L和2.054 mol/L之间
D.大于2.054 g/L
参考答案:D
本题解析:标准状况下,22.4 mL一氧化氮的物质的量为0.001mol;11.2 mL氧气的物质的量为0.0005mol;由方程式2NO+O2=2NO2可知,两气体恰好完全反应生成0.01molNO2气体;气体物质的量的减少,为保持压强不变,气体体积减小,又因为二氧化氮气体存在如下可逆反应: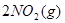 ?
? ,则可得容器内气体的密度大于2.054 g/L
,则可得容器内气体的密度大于2.054 g/L
本题难度:一般