1、选择题 0.1molMg分别在足量的O2、CO2、N2中燃烧,生成的固体质量依次为W1、W2、W3,则下列关系式中正确的是( )
A.W2>W1>W3
B.W1=W2>W3
C.W1=W2=W3
D.W3>W2>W1
参考答案:A
本题解析:
本题难度:一般
2、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热 至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的 解释不正确的是
?[? ]
A.铝箔在空气中不易燃烧
B.用酸处理时未能将氧化铝溶解
C.氧化铝的熔点比铝的熔点高
D.铝在空气中能很快形成氧化膜
参考答案:B
本题解析:
本题难度:简单
3、计算题 将等物质的量的两种氧化物溶于100 mL硫酸,而后逐滴加入1.00 mol·L-1的NaOH溶液。当加入的NaOH的体积V1="50" mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2="650" mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750 mL时,沉淀量不再改变。
(1)最初加入的50 mL NaOH溶液的作用是什么?
答:__________________________________________。
(2)画出沉淀量(m)随NaOH溶液体积滴入量的变化关系,并计算所用硫酸的浓度。
图4-5
(3)试判断两种氧化物各是什么,并计算其物质的量。
参考答案:(1)中和多余的H2SO4
(2)c(H2SO4)="3.25" mol·L-1
(3)氧化铝(Al2O3)0.05 mol、氧化铁(Fe2O3)0.05 mol。
本题解析:加入NaOH的体积与产生沉淀的量关系如图4-6所示:氧化物溶于硫酸后转化为相应的金属阳离子,最初加入50 mL NaOH溶液中和过量的H2SO4,当加入650 mL NaOH溶液时,沉淀达最大量,即所有的阳离子全部转化为沉淀,再继续加入NaOH溶液时,Al(OH)3沉淀会继续与NaOH作用转化为NaAlO2和H2O,且由题意可知Al(OH)3转化为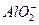 时消耗0.1 mol NaOH,则原溶液中含有0.1 mol Al3+,又因形成Al(OH)3沉淀时消耗NaOH 300 mL,再形成另一种沉淀物所消耗的NaOH也是300 mL,因两种氧化物的物质的量相等,则另一种氧化物也应为+3价金属的氧化物,即Fe2O3。
时消耗0.1 mol NaOH,则原溶液中含有0.1 mol Al3+,又因形成Al(OH)3沉淀时消耗NaOH 300 mL,再形成另一种沉淀物所消耗的NaOH也是300 mL,因两种氧化物的物质的量相等,则另一种氧化物也应为+3价金属的氧化物,即Fe2O3。
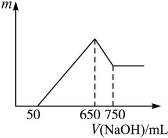
图4-6
本题难度:简单
4、填空题 (8分)某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝。请回答:
(1)两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为?、?。向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失;另一种溶液中的现象是____(填序号)。?
①产生白色沉淀?②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
(2)铝与氧化铁的反应可用于焊接钢轨,其反应的化学方程式为?。
参考答案:(1)FeCl3? AlCl3,?②?(2)2Al + Fe2O3 ?2Fe + Al2O3
?2Fe + Al2O3
本题解析:本题考查铁、铝及其化合物的化学性质及比较,①氧化物:铁的氧化物为碱性氧化物,与酸反应生成盐和水,即Fe2O3+6H+=2Fe3++3H2O,Al2O3为两性氧化物,既能与酸、又能与碱反应,Al2O3+6H+=2Al3++3H2O;②氢氧化物,氢氧化铝为两性氢氧化物,能与碱反应,故有Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO+2H2O,先产生沉淀,后溶解;而在Fe3+里,只产生红褐色的氢氧化铁沉淀;③铝与氧化铁的反应为铝热反应,
2Al+Fe2O32Fe+Al2O3。
本题难度:一般
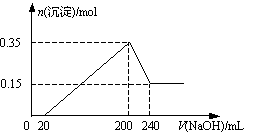
5、选择题 将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体,待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是 ( )
 ?
?
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
参考答案:C
本题解析:镁、铝分别与稀硫酸反应生成硫酸镁、硫酸铝以及氢气。根据图像可知,加入氢氧化钠溶液后并没有立即生成白色沉淀,这说明稀硫酸的是过量的。即氢氧化钠首先和过量的稀硫酸反应,然后在分别与硫酸镁、硫酸铝反应生成氢氧化镁、氢氧化铝沉淀。当氢氧化钠溶液过量时,氢氧化铝又溶解在氢氧化钠溶液中,生成偏铝酸钠和水。根据图像可知,与氢氧化铝反应的氢氧化钠水240ml-200mol=40ml。而沉淀减少了0.35mol-0.15mol=0.20mol,这说明氢氧化铝是0.2mol,氢氧化镁是0.15mol,所以镁和铝的总的质量是0.15mol×24g/mol+0.2mol×27g/mol=9g,和稀硫酸反应生成的氢气是0.3mol+0.15mol=0.45mol,标准状况下的体积是10.08L。根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,氢氧化钠的物质的量浓度是0.2mol÷0.04L=5.0mol/L。则沉淀最大值是生成硫酸钠是(0.2L×5mol/L)÷2=0.5mol,所以稀硫酸的浓度是0.5mol÷0.5L=1.0mol/L,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力培养与解题方法的指导与训练。该题的关键是明确反应的原理,然后再结合图像灵活运用即可,有利于培养学生的逻辑推理能力。
本题难度:简单