1、选择题 阿佛加德罗常数为6.02×1023 mol-1。下列叙述中不正确的是:?
A.0.1 mol OH-含有6.02×1023个电子
B.氯化氢气体的摩尔质量等于6.02×1023个氯化氢分子的质量之和
C.1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等
D.28 g氮气所含的原子数目为1.204×1024
参考答案:B
本题解析:略
本题难度:一般
2、计算题 (8分)取4.6g钠投入水中,完全反应后,溶液的体积为1L,问:(1)生成的气体体积在标准状况下为 多少升? (2)所得溶液溶质的物质的量浓度是多少?
多少升? (2)所得溶液溶质的物质的量浓度是多少?
参考答案:
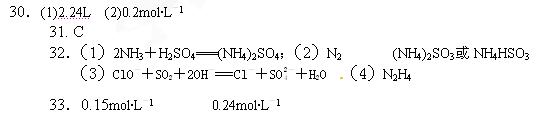
本题解析:略
本题难度:一般
3、简答题 实验室需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,实验操作步骤:
A.用托盘天平称取______?gCuSO4?5H2O晶体,放在烧杯中,用适量的蒸馏水使它溶解并恢复至室温.
B.用蒸馏水洗烧杯和玻璃棒2-3次,每次洗涤液都小心注入容量瓶,并轻轻振荡
C.继续向容量瓶加蒸馏水,至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切.
D.将制得的溶液通过玻璃棒引流,小心地移至容量瓶中.
E.将瓶塞塞紧,反复上下颠倒,摇匀.
请填写下列空白:
(1)需称______?gCuSO4?5H2O晶体
(2)操作步骤的正确顺序为______(填序号)
(3)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,
还缺少的仪器是______、______、______.
(4)下列情况会使所配溶液浓度偏低的是______(填序号)
a.定容时俯视.?b.没有进行上述的操作步骤B?
c.加蒸馏水时,不慎超过了刻度线?d.砝码上沾有杂质(或者使用生锈的砝码)
e.容量瓶使前未经干燥.
参考答案:(1)配制480mL溶液需选择500mL容量瓶,
所需CuSO4?5H2O的物质的量=500mL×10-3L/mL×0.2mol/L=0.1mol,
CuSO4?5H2O的质量=0.1mol×250g/mol=25.0g;
(2)配制一定物质的量浓度溶液的操作步骤为:
①用托盘天平称取25.0gCuSO4?5H2O晶体,放在烧杯中,用适量的蒸馏水使它溶解并恢复至室温;
②将制得的溶液通过玻璃棒引流,小心地移至容量瓶中;
③用蒸馏水洗烧杯和玻璃棒2-3次,每次洗涤液都小心注入容量瓶,并轻轻振荡;
④继续向容量瓶加蒸馏水,至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切.
⑤将瓶塞塞紧,反复上下颠倒,摇匀.
可知操作步骤的正确顺序为:ADBCE;
(3)根据操作过程可知:该实验中所需仪器为烧杯、天平、药匙、玻璃棒、500mL容量瓶、胶头滴管;
(4)a、定容时俯视,溶液的体积减小,所配溶液浓度偏高;
b、没有用蒸馏水洗烧杯和玻璃棒,溶质的质量减小,所配溶液浓度偏低;
c、加蒸馏水时超过刻度线,加水过多,使溶液体积增大,所配溶液浓度偏低;
d、砝码上沾有杂质(或者使用生锈的砝码),使溶质的质量增大,所配溶液浓度偏高;
e、容量瓶未经干燥,不影响溶液浓度.
故选bc.
故答案为:25.0;
(1)25.0;
(2)ADBCE;
(3)500mL容量瓶、胶头滴管、玻璃棒;
(4)bc.
本题解析:
本题难度:一般
4、选择题 NA为阿伏加德罗常数,下列叙述正确的是
A.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
B.用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属
C.1mol过氧化氢分子中共用电子对数为3NA
D.0.1mol Na2CO3·10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA
参考答案:C
本题解析:略
本题难度:简单
5、选择题 NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,32g O2含有的原子数为2NA
B.100mL 1mol·L-1氨水中,含有OH- 离子数是0.1 NA
C.100mL 2 mol·L-1碳酸钠溶液中,CO2-3离子数为0.2NA
D.标准状况下,22.4LCl2通入足量NaOH溶液,转移的电子数为2NA
参考答案:A
本题解析:A、常温常压下,32g O2含有1 NA的氧分子,有2NA氧原子,故A正确;B、氨水在溶液中不完全电离,含有OH- 离子数小于0.1 NA,故B错误;C、碳酸根在溶液中水解,其离子数小于0.2NA,故C错误;D、Cl2发生自身氧化还原反应,其中1个氯化合价降1,另1个升1,所以1mol Cl2转移电子数为:1mol,故D错误。
本题难度:一般