1、选择题 碘的熔、沸点较低,其原因是? (? )
A.碘的非金属性较弱
B.I2中I-I键不稳定
C.碘晶体属于分子晶体
D.碘的氧化性较弱
参考答案:C
本题解析:碘属于分子晶体,熔沸点较低
本题难度:简单
2、填空题
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题:
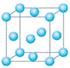
⑴写出铬原子的基态电子排布式_____________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有__________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为?。
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子。
⑶在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
参考答案:⑴1s22s22p63s23p63d54s1? K、Cu? 4?⑵非极性 ?⑶①③?直线形
本题解析:⑴ 24号Cr元素核外24个电子,最后6个电子的排布有两种可能:3d44s2或3d54s1。根据半满、全满规则可知后者更稳定。同理,可知最外层只有1个电子的除了K,还有3d104s1的Cu。
晶胞中原子的多少:8×1/8+6×1/2=4。
⑵根据相似相溶很容易判断。
⑶碳原子采取sp2杂化的键角为120°,符合条件的是 ①③。
本题难度:一般
3、填空题 (I)多项选择题CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是_______。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几体构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(Ⅱ)锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第_______周期______族,_______区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式_____________ ;葡萄糖分子中碳原子杂化方式有_____________________。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分 子”);在[ Zn(NH3)4]2+中,Zn2+位于正四面体的中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。

(4)图4表示锌与非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为____;该化合物的晶体熔点比干冰高得多,原因是___________________________。
参考答案:(I)CDE
(Ⅱ)(1)四;ⅡB; ds
(2)1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3
(3)极性分子;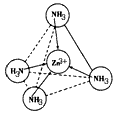
(4)ZnX;该化合物是原子晶体,而干冰是分子晶体
本题解析:
本题难度:一般
4、选择题
下列分子的立体结构,其中属于直线型分子的是?(?)
A.H2O
B.CO2
C.C2H2
D.P4
参考答案:答案:B C。
本题解析:
多原子分子若要属于直线型分子,中心原子应采用sp杂化,且无孤对电子
本题难度:一般
5、填空题 现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为_________;乙晶体的化学式为_______;丙晶体的化学式为________;丁晶体的化学式为_________。
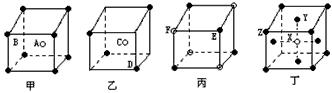
参考答案:1∶1;C2D;EF;XY3Z
本题解析:
本题难度:一般