1、选择题 下列离子方程式书写正确的是(? )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: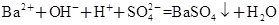
B.NH4HCO3溶液与过量KOH浓溶液共热: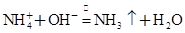
C.稀硝酸和过量的铁屑反应:
D.KI溶液与H2SO4酸化的H2O2溶液混合: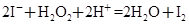
参考答案:D
本题解析:A项恰好为中性时,Ba(OH)2和NaHSO4按物质的量1∶2发生反应:Ba2++2OH-+2H++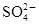 =BaSO4↓+2H2O。B项,
=BaSO4↓+2H2O。B项,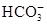 也与OH-反应,离子方程式为:
也与OH-反应,离子方程式为: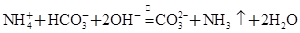 。C项,Fe过量应生成Fe2+
。C项,Fe过量应生成Fe2+
本题难度:一般
2、选择题 下列反应的离子方程式正确的是( )
A.过量的NaHSO4与Ba(OH)2反应:H++SO2-4+Ba2++OH-=BaSO4↓+H2O
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HC1O
C.用石墨作电极电解饱和NaCl溶液:Cl-+2H2O
Cl2↑+H2↑+OH-
D.向C6H5ONa溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO-3
参考答案:A.过量的NaHSO4与Ba(OH)2反应的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+H2O,故A错误;
B.向次氯酸钙溶液通入SO2的离子反应为Ca2++ClO-+SO2+H2O=CaSO4↓+2H++C1-,故B错误;
C.用石墨作电极电解饱和NaCl溶液的离子反应为2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-,故C错误;
D.向C6H5ONa溶液中通入少量CO2的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故D正确;
故选D.
本题解析:
本题难度:简单
3、填空题 (6分)写出下列反应的离子方程式
(1)铜与浓硝酸溶液反应
(2)碳酸氢铵溶 液中加入过量氢氧化钠溶液
液中加入过量氢氧化钠溶液
(3)向Ba(OH)2溶液中,逐滴加入过量的NaHSO4溶液至中性,
参考答案:
(1)Cu+4H++2NO3-=Cu2++2NO2↑+4H2O
(2)NH4++HCO3-+2OH-==NH3↑+CO32-+2H2O
(3)Ba2+ +2OH-+2H++SO42-==BaSO4↓+2H2O
+2OH-+2H++SO42-==BaSO4↓+2H2O
本题解析:略
本题难度:简单
4、填空题
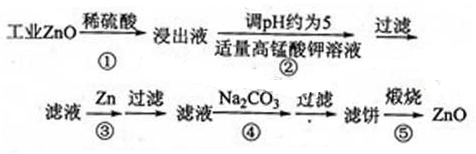
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是??,发生反应的离子方程式为 ?;在加高锰酸钾溶液前,若pH较低,对除杂的影响是?。
(2)反应③的反应类型为?,过滤得到的滤渣中,除了过量的锌外还有?。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是?。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于?。
参考答案:(1)Fe2+和Mn2+;
MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+;
3Mn2++2MnO4-+2H2O===5MnO2↓+4H+;不会形成Fe(OH)3和MnO2沉淀。或无法除去Fe2+和Mn2+;
(2)置换反应;Ni
(3)取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净。
(4)1
本题解析:
(1)根据题意,Ni(Ⅱ)不能被氧化,反应②中除掉的杂质离子是Fe2+和Mn2+,发生的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;加高锰酸钾溶液前,若pH较低,铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;?
(2)反应③为锌与镍离子的发生反应得到锌离子和镍,反应类型为置换反应;得到的滤渣中,除了过量的锌外还有金属镍。
(3)取最后一次少量水洗夜于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净。
(4)根据关系式
ZnCO3?xZn(OH)2~(x+1)ZnO
125+99x?81(x+1)
11.2g? 8.1g
解得:x=1
本题难度:一般
5、选择题 下列各式中属于正确的水解反应离子方程式的是( )
A.N
+H2O?NH3?H2O+H+
B.S2-+2H2O?H2S+2OH-
C.CH3COOH+H2O?CH3COO-+H3O+
D.CH3COOH+OH-?CH3COO-+H2O
参考答案:A.铵根离子水解生成一水合氨和氢离子,则属于水解离子反应,故A选;
B.硫离子水解分步进行,以第一步为主,不能一步完成,故B不选;
C.醋酸电离生成醋酸根离子和水合氢离子,则选项C为电离方程式,故C不选;
D.醋酸与碱反应生成盐和水,则选项D为中和的离子反应,故D不选;
故选A.
本题解析:
本题难度:一般