1、选择题 长期以来,人们一直认为氟的含氧酸不可能存在,但是自1971年两位美国科学家斯图查尔和阿佩里曼成功地合成次氟酸后,这种观点强烈地动摇了。他们在0℃以下将氟从细冰上面通过,得到了毫克量的次氟酸。已知次氟酸的分子组成与次氯酸相似,且次氟酸与热水剧烈反应,生成既有氧化性又有还原性的物质的溶液。则下列说法中不正确的(?)
A.次氟酸分子中原子间以共价键相结合
B.次氟酸分解会产生氟气
C.次氟酸与热水反应可能有H2O2生成
D.次氟酸的酸性可能比次氯酸强
参考答案:B
本题解析:A正确,HCLO分子的结构式为H—O—CL;B错,HCLO分解会生成氧气;C错,HCLO与热水反应生成HCL和氧气;D错,因F元素的非金属比CL元素的非金属性强,所以次氟酸的酸性不可能比次氯酸强
本题难度:一般
2、选择题 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O。对实验现象的“解释或结论”正确的是(?)

选项
| 实验现象
| 解释或结论
|
A
| a处变蓝,b处变红棕色
| 氧化性:Cl2>Br2>I2
|
B
| c处先变红,后褪色
| 氯气与水生成了酸性物质
|
C
| d处立即褪色
| 氯气与水生成了漂白性物质
|
D
| e处变红色
| 还原性:Fe2+>Cl-
|
?
参考答案:D
本题解析:a处变蓝,b处变红棕色,说明Cl2分别与KI、NaBr作用生成I2、Br2,可证明氧化性:Cl2>I2,Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,A项错误;c处先变红,说明氯气与水生成酸性物质,后褪色,则证明氯气与水生成具有漂白性物质,B项错误;d处立即褪色,也可能是氯气与水生成酸性物质中和了NaOH,C项错误;e处变红说明Cl2将Fe2+氧化为Fe3+,证明还原性:Fe2+>Cl-,D项正确。
本题难度:一般
3、填空题 为验证卤素单质氧化性的相对强弱,某小组用右图所示装置进行试验(夹持仪器已略去,气密性已检验)。试验过程:
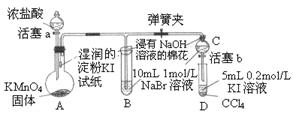
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕色时,关闭活塞a。
IV.……
试回答下列问题:
(1)A中产生?色气体,其结构式是?。
(2)能使湿润的淀粉—KI试纸变蓝的气体是?。
(a) Cl2 (b) N2O4 (c) I2蒸气 (d) SO2 (e) O3 (f) CO2
(3)滴加浓盐酸前,分液漏斗首先要?。
(4)过程III实验目的是?。
(5)A中产生氯气的离子方程式为?。
(6)B中浸有NaOH溶液的棉花作用是?,写出反应的离子方程式?。
参考答案:
a、b、c、e
本题解析:略
本题难度:简单
4、填空题 (14分)瑞典化学家舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
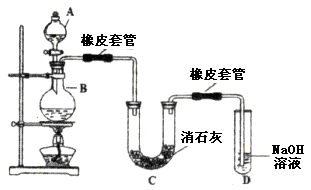
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得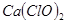 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成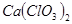 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: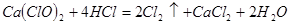 ,该反应中每生成
,该反应中每生成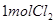 ,转移电子的物质的量为__________
,转移电子的物质的量为__________ ,被氧化的
,被氧化的 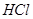 的物质的量为__________
的物质的量为__________ 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效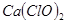 的含量大小的标志。已知:
的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)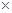 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中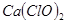 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。
参考答案:1)分液漏斗,浓盐酸,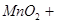
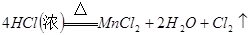 ,
,
(2)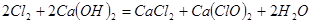 。
。
(3)①将U形管置于冷水浴中。
②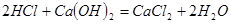 。在B、C之间增加一个饱和食盐水洗气装置。
。在B、C之间增加一个饱和食盐水洗气装置。
(4)1? ? 65.5%
? 65.5%
本题解析:(1)A仪器的名称是分液漏斗,所盛试剂是浓盐酸,B中发生反应的化学方程式是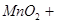
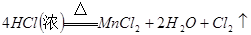 ;
;
(2)漂白粉将在U形管中产生,其化学方程式是: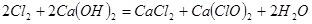
(3)①温度较高时氯气与消石灰反应生成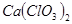 ,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
②另一个副反应(写出此反应方程式):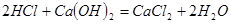 ;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
(4)漂粉精同盐酸作用产生氯气: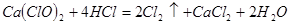 ,该反应中每生成
,该反应中每生成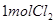 ,转移电子的物质的量为
,转移电子的物质的量为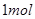 ,被氧化的
,被氧化的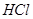 的物质的量为
的物质的量为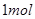 ;
;
本题难度:一般
5、填空题 (8分)回答下列问题:
(1)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是?,该实验说明的问题是?。
(2)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是?(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是?。
参考答案:(1)SO2;SO2与有色物质结合成的无色物质不稳定
(2)氯化钡溶液。SO2+C12+2H2O=4H++SO42-+2Cl-
本题解析:(1)SO2的漂白原理是与有色物质化合,生成不稳定的无色物质。在加热的条件下,能恢复到用来的颜色,而氯气的漂白是通过次氯酸的氧化,是不可逆的。所以溶液又呈红色的是SO。
(2)如果二者发生氧化还原反应,则一定是氯气为氧化剂,SO2是还原剂,生成物一定有硫酸,据此可以通过检验SO42-来验证,因此加入的试剂是氯化钡。SO2和氯气反应的方程式为SO2+C12+2H2O=4H++SO42-+2Cl-。
本题难度:一般