1、选择题 下面对氯气的叙述正确的是( )
A.氯气可使湿的红布条褪色,所以氯气具有漂白性
B.氯气没有漂白性,但通入品红溶液中,品红褪色
C.氯气可以和任何金属直接化合
D.氯气有毒,闻其气味时要小心将集气瓶放在鼻孔下直接闻其气味
2、选择题 下列说法正确的是( )。
A.打开盛浓盐酸的试剂瓶可看到白色的雾,这说明HCl不稳定
B.蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸
C.胆矾晶体中滴入浓硫酸,胆矾由蓝色变为白色,这说明浓硫酸有脱水性
D.碳酸、亚硫酸和次氯酸都是不稳定性酸
3、填空题 新制的氯水显______色,这是因为氯水中有______分子(填微粒符号)存在,向氯水中滴入几滴AgNO3溶液,观察到的现象是______,说明氯水中有______(填微粒符号)存在.蓝色石蕊试纸遇到氯水后,首先变红,得很快又褪色,这是因为______氯水经光照后,黄绿色逐渐消失,并放出气体,该反应化学方程式是______.
4、填空题 离子化合物AB2的阴、阳离子的电子层结构相同,1 mol AB2中含54 mol电子,且有下列反应:
①H2+B2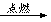 C
C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,Z有漂白作用。
根据上述条件回答下列问题:
(1)写出下列物质的化学式:AB2__________,X________,Y________,Z________。
(2)用电子式表示AB2的形成过程:_____________________________________________。
(3)写出反应②的化学方程式:______________________________________。
5、实验题 无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
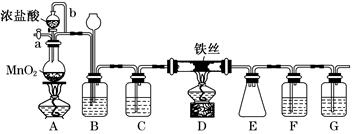
请回答:
(1)装置A中反应的离子方程式为__________________________________________。
(2)装置F中所加的试剂为_________________________________________________。
(3)导管b的作用为_____________________________________________________;
装置B的作用为________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为_______________________________________________________。
(5)反应结束后,拆卸装置前,必须进行的操作是_________________________________
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________(填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液