1、简答题 美国科学家理查德一海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖.有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收.一种由废催化剂制取氯化钯的工艺流程如下:
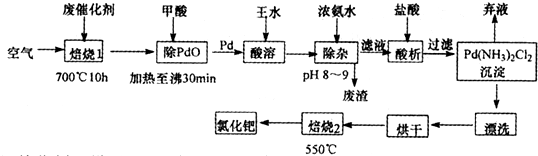
(1)废钯催化剂经烘干后,再在700℃的高温下焙烧,焙烧过程中需通入足量空气的原因是______;甲酸还原氧化钯的化学方程式为______.
(2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______.
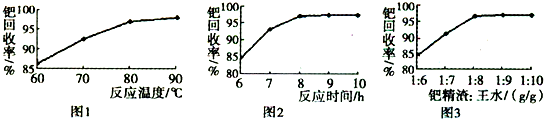
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为______、______、______.
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是______(写化学式).
(5)700℃焙烧1的目的是:______;550℃焙烧2的目的是:______.
2、实验题 20.6gNH4HCO3和NaHSO3的干燥粉状混合物,用加热分解的实验方法来测定NH4HCO3的质量分数。已知:NaHSO3加热时会产生SO2。根据下图所示的仪器和所盛试剂填空:
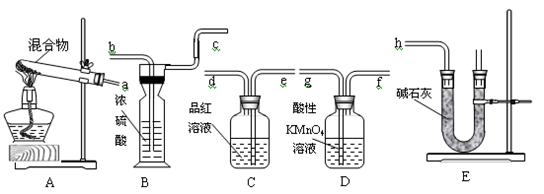
(1)按照气流由左→右的方向连接仪器的顺序(用a~h表示)为____________________。
(2)仪器B的名称为_________,E装置中放碱石灰的仪器名称为________,A和E装置中都用到的仪器名称为__________。
(3)D的作用是_______________________________________________________。
(4)C的作用是_________________________________;若C瓶中溶液颜色有变化,则测定结果可能会偏__________。
(5)B的作用是_____________________________________。
3、实验题 (16分)溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是?(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是?。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
?
| 操作
| 预期现象及结论
|
方案1
| 取少量黄色溶液,加入NaOH溶液
| 如果生成红褐色沉淀,则说明发生了反应
|
方案2
| 取少量黄色溶液,加入淀粉碘化钾溶液
| 如果溶液变蓝色,则说明未发生反应
|
方案3
| 取少量黄色溶液,加入四氯化碳,振荡
| 如果下层溶液呈橙红色,则说明:
?
|
①方案1是否合理??(填“合理”或“不合理”)。
方案2中,由于存在反应?(用离子方程式表示),所以预测结论不正确。
②请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
实验操作
| 预期现象及结论
| 解释现象的离子方程式
|
?
| ?
| ?
4、选择题 下列实验不能达到预期目的的是
代号
| 实?验
| 实验目的
| A
| Cl2、Br2分别与H2反应
| 比较氯与溴的非金属性强弱
| B
| 同温下测定相同浓度的Na2CO3,
和Na2SO4溶液的酸碱性
| 比较硫酸与碳酸的酸性强弱
| C
| AlCl3、MgCl2溶液中通人过量氨气
| 比较镁与铝单质的还原性强弱
| D
| 同温下用同一电路分别测定同浓度的
盐酸和某一元酸溶液导电能力
| 比较该一元酸与盐酸酸性的强弱
5、选择题 下列实验装置与实验操作正确的是
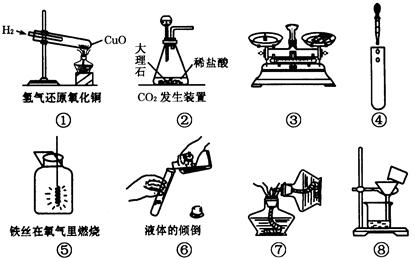
A.①④⑤
B.②③⑧
C.④⑥
D.⑤⑦
|
|