1、选择题 在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A.pH=3的HNO3跟pH=11的KOH溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钠溶液
2、选择题 已知100℃的温度下,水的离子积Kw=1×10-12。本题涉及的溶液,其温度均为100℃。下列说法中正确的是
[? ]
A.0.005 mol/L的H2SO4溶液,pH=2
B.0.001 mol/L的NaOH溶液,pH=11
C.0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
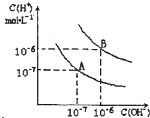
3、填空题 已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(2)95℃时,若pH=a的某强酸溶液与pH=b的某强碱溶液等体积混合后溶液呈中性,则a与b应满足的关系是______.
(3)曲线B对应温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:______.
4、填空题 25℃时,若体积为Va、pH=a 的某一元强酸与体积为Vb、pH=b 的某一元强碱混合,恰好中和,且已知Va>Vb和 a=0.5b。则:
(1)a值可否等于3 (填“可”或“否”)_____ ,其理由是 ___________________。
(2)a值可否等于5(填“可”或“否”)_____ _,其理由是 __________________。
(3)a 的取值范围 ____________。
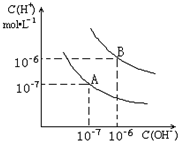
5、填空题 已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为______;(填“A”或“B”),请说明理由______;
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______;曲线B对应温度下,250mL?0.lmol/L的HCl溶液和250mL0.3mol/L的NaOH溶液混合,求混合后溶液的pH=______;
(3)25℃时,将PH=13的NaOH溶液l0mol逐滴滴入PH=1的CH3COOH溶液10ml中,反应后溶液的pH______?7(填“>”、“<”或“=”).
(4)-50℃时,液氨存在如下电离:2NH3?NH4++NH2-,K=2×10-12,往液氨中加入NH4C1固体,K______2×10-12(填“<”、“>”或“=”)