1、选择题 X,Y,Z,W四种短周期元素,若①X的阳离子与Y阴离子具有相同的电子层结构.②W的阳离子的氧化性强于同主族带等电荷数的X的阳离子的氧化性.③Z的阴离子半径大于同主族带等电荷的Y的离子半径.则这四种元素的原子序由大到小的顺序为( )
A.W>Y>X>Z
B.Z>Y>W>X
C.X>Y>Z>W
D.Z>X>Y>W
参考答案:D
本题解析:
本题难度:一般
2、选择题 X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期,X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列说法不正确的是( )
A.三种元素的非金属性由弱到强的顺序为Z<Y<X
B.Y元素的最高价氧化物对应水化物的化学式可表示为H2YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小排列顺序为Z>Y>X
参考答案:X、Y、Z都是短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一主族,故Y为硫元素;Y、Z位于同一周期,Z原子的核外电子数比Y原子少1,故Z为磷元素.A、同周期自左而右非金属性增强,同主族自上而下非金属性减弱,所以非金属性P<S<O,即Z<Y<X,故A正确;
B、Y为硫元素,最高价氧化物对应水化物的化学式可表示为H2SO4,故B正确;
C、非金属性P<S<O,非金属性越强,氢化物越稳定,所以氢化物稳定性Z<Y<X,故C错误;
D、同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以原子半径P>S>O,即Z>Y>X,故D正确.
故选:C.
本题解析:
本题难度:一般
3、简答题 短周期中的A、B、C、D、E?5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2-离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1:1的离子化合物.
(1)由A、C、E?三种元素组成的一种化合物常用作消毒液其名称为______.
(2)D、E元素可组成化合物甲,用石墨为电极电解甲的水溶液时,阳极的电极反应式为______;阴极区溶液的pH______.
(3)A、C元素可组成原子个数比为1:1的共价化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为______.
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种.X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7.将0.2mol?L-1的X溶液与0.1mol?L-1的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为______,Y的化学式为______.
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为______.
参考答案:C2-离子与D+离子的核外电子数相等,由电荷可知C为ⅥA族元素,D为ⅠA族元素,A、D同主族,则A可为H元素,D为Na元素,C为O元素,A、B的原子序数之和等于C的原子序数,则B为N元素,B原子与D+离子的核外电子数之和等于E原子的核外电子数,E的核外电子数为7+10=17,则E的原子序数为17,E为Cl元素,
(1)由H、O、Cl三种元素组成的一种化合物常用作消毒液,应为HClO,名称为次氯酸,故答案为:次氯酸;
(2)电解NaCl溶液,阳极反应式为2Cl--2e-=Cl2↑,阴极反应式为2H2O+2e-=H2↑+2OH-,阴极生成OH-,则pH增大,大于7,
故答案为:2Cl--2e-=Cl2↑;大于7;
(3)A、C元素可组成原子个数比为1:1的共价化合物为H2O2,与Cl2发生氧化还原反应,生成的强酸为HCl,气体为O2,反应的化学方程式为Cl2+H2O2=2HCl+O2↑,
故答案为:Cl2+H2O2=2HCl+O2↑;
(4)①X能促进水的电离,X水溶液的pH<7,说明水解呈酸性,应为铵盐,可能为NH4Cl(或NH4NO3),Y能抑制水的电离,Y水溶液的pH>7,抑制水的电离,应为碱,可为NaOH,
故答案为:NH4Cl(或NH4NO3);NaOH;
②将0.2mol?L-1的NH4Cl(或NH4NO3)溶液与0.1mol?L-1的NaOH溶液等体积混合后,反应后溶液中存在NH4+和NH3?H2O,
离子浓度大小顺序为c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)[或c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)],
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)[或c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)].
本题解析:
本题难度:一般
4、简答题 有A、B、C、D四种短同期元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、A、D的顺序增大.已知B、C的次外层电子数为2,D、A的次外层电子数均为8,且A、D原子的电子层数相同.请回答:
(1)写出A、B、C、D的元素符号:A______、B______、C______、D______.
(2)画出A的原子结构示意图:______;
(3)写出AD的电子式:______;
(4)写出A、C的最高价氧化物对应水化物相互反应的化学方程式:______.
参考答案:(1)短周期元素的最高化合价等于族序数,所以A在ⅠA族、B在ⅣA族、C在ⅤA族、D在ⅤⅡA族,又A、D的次外层电子数为8,则A、D均为第三周期元素,A为Na、D为Cl;B、C的次外层电子数为2,在第二周期,所以B为C、C为N.
故答案为:Na、C、N、Cl;
(2)A为Na,核外有三个电子层,电子数分别为2、8、1,原子结构示意图为
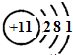
,
故答案为:
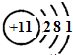
;
(3)AD为氯化钠,是离子化合物,电子式中氯离子应用中括号括起来且右上角标出所带电荷,电子式为
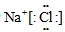
,
故答案为:
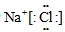
;
(4)A、C的最高价氧化物对应的水化物分别为NaOH、HNO3,二者反应生产NaNO3和H2O,反应的方程式为NaOH+HNO3═NaNO3+H2O,
故答案为:NaOH+HNO3═NaNO3+H2O.
本题解析:
本题难度:一般
5、填空题 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C单质燃烧时呈现黄色火焰,C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)C离子结构示意图:______.
(2)AB2的结构式为______.
(3)C2D的电子式:______.
(4)写出由B、C、D三种元素组成的两种化合物的化学式______,______.
参考答案:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素.
(1)钠离子质子数为11,核外电子数为10,最外层有8个电子,钠离子结构示意图为
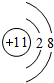
.
故答案为:
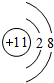
.
(2)CO2分子中碳原子与氧原子形成2对共用电子对,结构式为O═C=O.
故答案为:O═C=O.
(3)C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为

.
故答案为:

.
(4)B为氧元素,C为钠元素,D为硫元素,由B、C、D三种元素组成的两种化合物的化学式为Na2SO4、Na2SO3.
故答案为:Na2SO4、Na2SO3.
本题解析:
本题难度:简单