1、选择题 由非金属元素组成的化合物(? )
A.一定是共价化合物
B.一定是离子化合物
C.不可能是原子晶体
D.可能是离子晶体
参考答案:D
本题解析:由非金属元素组成的物质可能是NH4Cl、NH4NO3(离子晶体);H2O(共价化合物);金刚石(原子晶体)。
本题难度:一般
2、填空题 (7分)Ⅰ.①MgCl2?②干冰③冰?④Na2O2?⑤白磷(P4)⑥硫磺?⑦Na2CO3?⑧金刚石?⑨NaOH?⑩SiO2
(1)以上物质中属于离子晶体的是?;(2)属于分子晶体的是?。(3)属于原子晶体的是______(均填序号)。
Ⅱ。下列物质中:(1)互为同分异构体的有?;(2)互为同素异形体的有?;(3)属于同位素的有?;(4)属于同一种物质(分子组成相同)的有?。(均?填序号)
①液氯?②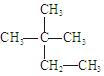 ③白磷?④氯气?⑤
③白磷?④氯气?⑤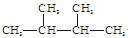
⑥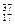 Cl?⑦
Cl?⑦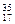 Cl?⑧红磷
Cl?⑧红磷
参考答案:每空1分,共7分。
Ⅰ(1)①④⑦⑨?(2)②③⑤⑥?(3)⑧⑩
Ⅱ(1)②⑤?(2)③⑧?(3)⑥⑦?(4)①④
本题解析:略
本题难度:一般
3、选择题 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如下图所示。则这种合金的化学式为
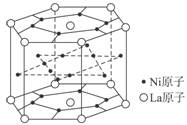
A.LaNi6
B.LaNi3
C.LaNi4
D.LaNi5
参考答案:D
本题解析:采用计数法求解。在内部的原子,完全属于该晶体;在面上的原子,只属于晶体的1/2;在顶点上的原子,属于该晶体的1/6。
本题难度:一般
4、选择题 下列各项中,理由、结论及因果关系均正确的是
选项
| 理由
| 结论
|
A
| 键能:N≡N>Cl-Cl
| 单质沸点:N2>Cl2
|
B
| 分子中可电离的H+个数:H2SO4>CH3COOH
| 酸性:H2SO4>CH3COOH
|
C
| 元素的非金属性:N>P
| 酸性:HNO3>H3PO4
|
D
| 氧化性:Fe3+>Cu2+
| 还原性:Fe2+>Cu
|
?
参考答案:C
本题解析:分子晶体的键能决定了它们的稳定性,而分子间作用力决定其溶沸点,错误;B、酸性的强弱与酸电离出H+的难易程度有关,与每个分子电离出H+个数无关,错误;C、元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,正确;D、一般来说微粒的氧化性越强,其对应的得电子后的还原性微粒还原性就越弱,故Fe2+<Cu,错误。
本题难度:简单
5、填空题 已知有关物质的溶、沸点数据如下表所示:
化合物
| MgO
| Al2O3
| MgCl 2
| AlCl3
|
熔点/℃
| 2852
| 2072
| 714
| 190(2.5*105Pa)
|
沸点/℃
| 3600
| 2980
| 1412
| 182.7
|
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl 2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
答:__________________________________________________________________
(2)氯化铝是________________(填晶体类型)
(3)在500K和1.01*105Pa时,氯化铝的蒸气密度(换算为标准状况时)为11.92g/L,试确定氯化铝在蒸气状态时的化学式为___________________
(4)无水氯化铝在空气中剧烈“发烟”,其原因是________________
(5)设计可靠的实验证明MgCl 2、AlCl3所属的晶体类型,其实验方法是_____________.
参考答案:(1)因为MgO的熔点远高于MgCl 2,所以电解熔融的MgNa需要提供更多的能量、更高的温度,不易于操作。从表中数据可以发现,AlCl3晶体的熔点很低,易升华,属于分子晶体,不存在离子,熔融时不能导电,不能被电解。
(2)属于分子晶体
(3)根据氯化铝的蒸气密度可以求得其摩尔质量,进而确定化学式
M=ρ﹡Vm=11.92g/L×22.4L/mol=267g/mol,所以化学式为Al2Cl6
(4)无水氯化铝在空气中与水发生水解反应产生HCl气体,HCl在空气中形成酸雾而“发烟”
(5)将两种晶体加热到熔化状态,MgCl 2能导电而AlCl3不能导电,故可证明MgCl 2为离子晶体,AlCl3为分子晶体。
本题解析:解析同答案
本题难度:一般