1、推断题 化合物A、D、F是中学化学中常见的物质,化合物B、C、E中含有两种相同的元素。这些化合物之间存在下面的转化关系。其中A和B的反应是一种重要化工生产中的主要反应之一。

(1)在B、C、E中含有相同的元素是________________。
(2)化合物C的化学式是__________________
(3)C的水溶液和D能否发生反应?___________,其理由是____________________
参考答案:(1) Si、O
(2)Na2SiO3或K2SiO3
(3)能;较强酸制较弱的酸
本题解析:
本题难度:一般
2、选择题 科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用.下列关于硅的说法中错误的是( )
A.自然界硅的贮量丰富
B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片
D.光导纤维的主要成分是SiO2
参考答案:B
本题解析:
本题难度:一般
3、选择题 进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是
A.SO2气体使溴水褪色,表现了SO2的漂白性
B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
C.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应
D.向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜
参考答案:B
本题解析:分析:A、二氧化硫具有还原性被溴水氧化反应,漂白性是二氧化硫的特征性质和有色物质结合为无色物质;
B、浓硝酸生成的二氧化氮气体溶于硝酸溶液中变黄色;
C、常温下铝在浓硫酸中发生钝化现象,是强氧化性的表现;
D、钠是活泼金属在硫酸铜溶液中先和水反应;
解答:A、漂白性是二氧化硫的特征性质和有色物质结合为无色物质,通入溴水是含有溴单质为溴离子,发生的是氧化还原反应,故A错误;
B、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色气体二氧化氮且溶于浓硝酸形成,故B正确;
C、常温下,将铝片放入浓硫酸中,无明显现象,说明铝在冷的浓硫酸中发生钝化现象,反应生成一薄层致密的氧化物薄膜阻止反应进行,是强氧化性的表现,故C错误;
D、向CuSO4溶液中加入一小块金属钠,钠与水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜,不能置换出铜,故D错误;
故选B.
点评:本题考查二氧化硫、浓硝酸、浓硫酸、钠等物质的性质分析应用,掌握物质性质是解题关键,题目难度中等.
本题难度:简单
4、简答题 .某科研小组用高岭土(主要成分是Al2O3?2SiO2?2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物).试验流程如下:
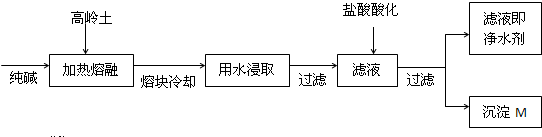
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似.用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式______、
______.
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器______(填写编号)
A.铁坩埚?B.瓷坩埚?C.氧化铝坩埚?D.玻璃坩埚
(3)写出上述过程中,最后得到的沉淀M的化学式______.
参考答案:(1)氧化铝以及二氧化硅与碳酸钠的反应为:Na2CO3+Al2O3?高温?.??2NaAlO2+CO2↑、Na2CO3+SiO2??高温?.??Na2SiO3+CO2↑,故答案为:Na2CO3+Al2O3?高温?.??2NaAlO2+CO2↑、Na2CO3+SiO2??高温?.??Na2SiO3+CO2↑;?
?(2)瓷坩埚、玻璃坩埚的成分中含有二氧化硅,能和纯碱发生反应,氧化铝坩埚也能和纯碱发生反应,在加热时反应易使坩埚炸裂,故答案为:A.
(3)向滤液硅酸钠中加入盐酸能获得硅酸沉淀和氯化钠溶液,所以最后得到的沉淀M的化学式为H4SiO4(或?H2SiO3),故答案为:H4SiO4(或?H2SiO3?).
本题解析:
本题难度:一般
5、选择题 化学知识可以帮助理解和解决日常生活中遇到的许多问题,下列说法错误的是( )
A.胃酸过多的病人,可以服用氢氧化钠来中和胃酸
B.晶体硅是在通信工程中制作光导纤维的主要原料
C.液氯罐泄漏,可将其移入水塘中并撒入生石灰
D.二氧化硅与氢氟酸的反应原理可用来雕刻玻璃
参考答案:AB
本题解析:
本题难度:一般