1、填空题 (6分)在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式?,反应中的还原剂是?,每摩NaBH4反应时电子转移数为?mol。
⑵NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
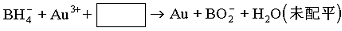
请写出配平的离子方程式?。
参考答案: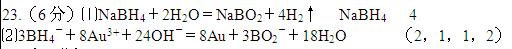
本题解析:略
本题难度:一般
2、选择题 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+xOH—
+O2+xOH—?Fe3O4+S4O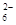 +2H2O,
+2H2O,
下列说法中,正确的是(?)?
A.每生成1mol Fe3O4,反应转移的电子总数为3mol ;
B.x="6"
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol;
D.Fe2+和S2O32—-都是还原剂;
参考答案:D
本题解析:根据氢原子守恒或氧原子守恒或电荷守恒,都可推出X=4,B项错误;分析反应中元素的化合价变化,3mol Fe2+反应时,2molFe2+被氧化失2mole-, 2molS2O 生成1molS4O
生成1molS4O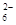 失2mol e-,共转移4mol e-,故A项错误,D项正确;根据电子得失可知,1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/4mol。
失2mol e-,共转移4mol e-,故A项错误,D项正确;根据电子得失可知,1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/4mol。
本题难度:一般
3、选择题 下列实验现象与氧化还原反应有关的是
[ ? ]
A.碳酸钠中加入CaCl2溶液产生白色沉淀物
B.硫酸铜溶液中插入铁片,铁片上出现红色沉淀物
C.石灰石溶于盐酸并产生气泡
D.铁在氧气中燃烧,剧烈反应火星四射
参考答案:BD
本题解析:
本题难度:简单
4、选择题 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
[? ]
A.SO2
B.Cl-
C.Fe3+
D.NO3-
参考答案:D
本题解析:解析:
铁离子具有氧化性,能把SO2氧化生成硫酸,从而生成硫酸钡沉淀。铁离子被还原生成亚铁离子。但在酸性溶液中NO3-具有氧化性,能把亚铁离子氧化生成铁离子, 所以最终被还原的是NO3-,故D正确。
故选:D
本题难度:一般
5、选择题 向含NaBr和NaI的溶液中,通入Cl2,充分反应后将所得的溶液蒸干、灼烧,将得到的固体冷却后称量。称量固体的质量与通入Cl2的体积关系如图所示:则原混合液中NaI的物质的量为
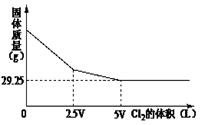
A.52.5g
B.60g
C.45g
D.37.5g
参考答案:D
本题解析:由于溴离子的还原性弱于碘离子的,所以氯气首先氧化碘化钠。根据图像可知,2.5vL的氯气是用来氧化碘化钠的,另外2.5VL的氯气用来氧化溴化钠。由于碘单质易升华,溴单质易挥发,所以最终得到的固体是氯化钠,质量是29.25g,物质的量是0.5mol,所以参加反应的氯气是0.25mol,则和碘化钠反应的氯气是0.125mol,则碘化钠的物质的量是0.25mol,质量是37.5g,答案选D。
本题难度:简单