1、填空题 在温度和压强相等的条件下,氧气和氢气的密度比为_________,质量相等时的体积比为_________,体积相等时的物质的量之比为___________。
参考答案:16:1;1:16;1:1
本题解析:
本题难度:一般
2、选择题 在给定温度和压强下的理想气体,影响其所占体积大小的主要因素是:
A.分子直径的大小
B.分子间的距离
C.分子数目的多少
D.分子间引力的大小
参考答案:C
本题解析:影响物质体积的因素有微粒数目的多少、微粒的大小、微粒间的间隔。对于气体来说微粒之间的间隔是它本身直径的10倍,微粒运动的空间是它大小的1000倍,所以它本身的大小就可以忽略不计。微粒间的间隔受外界条件的影响,主要受温度和压强的影响。当温度和压强一定时分子间的间隔就不变,这时影响物质体积大小的因素就只有分子数的多少。分子数越多,它所占的体积就越大;分子数越少,她所占的体积就越小。故正确选项为C。
本题难度:简单
3、选择题 在标况下,下列气体的密度按由小到大的顺序排列的是
[? ]
①氮气 ②氯气 ③氨气 ④一氧化碳 ⑤氯化氢
A、①<②<③<④<⑤
B、③<④=①<⑤<②
C、③<①<④<⑤<②
D、⑤<④=①<③<②
参考答案:B
本题解析:
本题难度:简单
4、选择题 若阿伏加德罗常数的数值为NA,则下列说法中正确的是
A.1.0L0.1 mol·L-1Na2S溶液中含有的S2-离子数小于0.1NA
B.1 molFe与过量的氯气反应,转移电子的数目为2 NA
C.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
D.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
参考答案:A
本题解析:n(Na2S)=0.1mol·L-1×1.0L=0.1mol,Na2S =2Na++ S2-,n(S2-)= n(Na2S)=0.1mol,但是Na2S是强碱弱酸盐,S2-能水解,则溶液中n(S2-)<0.1mol,故A正确;根据氯气的性质可知,2Fe+3Cl2=2FeCl3~6e-,根据系数之比等于物质的量之比可知,1mol铁与过量氯气反应转移3mol电子,故B错误;缺少标准状况下,气体摩尔体积不一定等于22.4L/mol,则混合气体不一定为0.1mol,所含碳原子不一定为0.1mol,故C错误;n(H2SO4)="18.4" mol·L-1×0.05L=0.92mol,Cu+2H2SO4(浓)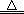 CuSO4+SO2↑+2H2O,但是生成的n(SO2)一定小于0.46mol,因为铜足量,浓硫酸变为稀硫酸,所以参加上述反应的n(H2SO4)一定小于0.92mol,故D正确。
CuSO4+SO2↑+2H2O,但是生成的n(SO2)一定小于0.46mol,因为铜足量,浓硫酸变为稀硫酸,所以参加上述反应的n(H2SO4)一定小于0.92mol,故D正确。
本题难度:简单
5、选择题 (附加题)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
[? ]
A.?甲的分子数比乙的分子数多?
B.?甲的物质的量比乙的物质的量少
C.?甲的摩尔体积比乙的摩尔体积小?
D.?甲的相对分子质量比乙的相对分子质量小
参考答案:B
本题解析:
本题难度:简单