1、选择题 把a g 铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍 为a g,则此合金中铝的质量分数为(?)
为a g,则此合金中铝的质量分数为(?)
A.70%
B.30%
C.52.4%
D.22.2%
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列氯化物中,能直接利用金属与稀盐酸反应得到的是
A.FeCl3
B.CuCl2
C.MgCl2
D.AgCl
参考答案:C
本题解析:分析:盐酸具有弱氧化性,能与金属活动性顺序表中氢之前的金属发生置换反应,和变价金属反应只能生成低价盐.
解答:A、盐酸具有弱氧化性,和铁反应生成氯化亚铁,不是氯化铁,故A错误.
B、铜在金属活动性顺序表中氢之后,所以铜和盐酸不反应,故B错误.
C、镁在金属活动性顺序表中氢之前,所以镁和盐酸反应生成氯化镁,故C正确.
D、银在金属活动性顺序表中氢之后,所以银和盐酸不反应,故D错误.
故选C.
点评:本题考查了金属和稀盐酸的性质,难度不大,注意稀盐酸有弱氧化性,且氧化性是氢元素表现的,和变价金属反应只能生成低价态的氯化物.
本题难度:简单
3、计算题 将镁粉和碳酸镁的混合物置于氧气中灼烧,直至质量不再改变为止。经测定,灼烧后所得固体质量与原混合物质量相同,求原混合物中镁粉和碳酸镁的质量比。
参考答案:11∶14
本题解析:整个题目全用文字叙述,没有一个可供直接利用的具体数据。仔细审视题意,抓住关键词语,将“灼烧后所得固体质量与原混合物质量相同”转化为(化隐含为显露)“Mg吸收的O2质量等于MgCO3分解放出的CO2质量”,即可由2Mg→O2和MgCO3→CO2,导出44Mg→16MgCO3。这一关系式表明,在原混合物中镁粉与碳酸镁的质量比是44×24∶16×84=11∶14。
本题难度:简单
4、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
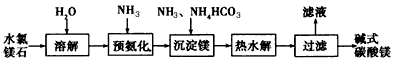
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp= 1.8×l0-11,若溶液中c(OH-) =3.0×10-6mol/L,则溶液中c(Mg2+)=_____
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO20.896 L,通过计算确定碱式碳酸镁的化学式。_____________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数____(填“升高”、“降低”或“不变”)。
参考答案:(1)2.0 mol/L
(2)NH4Cl
(3)
n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00 ×10-2:5.00×10-2 =5:4:5 ,碱式碳酸镁的化学式为:Mg(OH)2·4MgCO3·4H2O
(4)升高
本题解析:
本题难度:一般
5、选择题 下列解释实验事实的化学方程式正确的是
A.5molFe和4molCl2反应:5Cl2+4Fe点燃2FeCl2+2FeCl3
B.2molKMnO4和3molH2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=Mn2++4O2↑+6H2O
C.在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O
D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
参考答案:C
本题解析:A、铁与氯气反应只能生成氯化铁,A不正确;B、酸性高锰酸钾氧化双氧水的离子方程为2MnO4-+5H2O2+6H+=Mn2++5O2↑+5H2O,B不正确;原电池中负极失去电子,则甲醇在负极通入,与氢氧根结合生成碳酸根和水,C正确;D、向NaAlO2溶液中通入过量CO2生成氢氧化铝和碳酸氢钠,D不正确,答案选C。
本题难度:一般