1、选择题 ?一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH
| 2
| 4
| 6
| 6.5
| 8
| 13.5
| 14
|
腐蚀快慢
| 较快
| 慢
| 较快
|
主要产物
| Fe2+
| Fe3O4
| Fe2O3
| FeO2-
|
下列说法不正确的是
A.在pH<4溶液中 ,碳钢主要发生析氢腐蚀
B.存pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
参考答案:C
本题解析:A、酸性条件下,碳钢发生析氢腐蚀,Fe-2e-= Fe2+,正确;B、当pH>6溶液中,碳钢主要发生吸氧腐蚀,负极电极反应式为:Fe-2e-=Fe2+,正极上电极反应式为:O2+2H2O+4e-=4OH-,正确;C.在pH>14溶液中,碳钢腐蚀的正极反应O2+2H2O+4e-=4OH-,错误;D.在煮沸除氧气后的碱性溶液中,正极上氧气生成氢氧根离子速率减小,所以碳钢腐蚀速率会减缓,正确,答案选C。
本题难度:一般
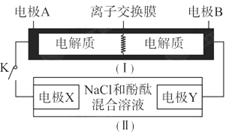
2、选择题 如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许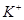 通过,该电池放电时的化学方程式为:
通过,该电池放电时的化学方程式为: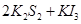 ?=
?=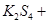 3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是?(? )
3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是?(? )
 ?
?
A.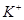 从右到左通过离子交换膜
从右到左通过离子交换膜
B.电极A上发生的反应为: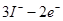 =
=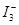
C.电极X上发生的反应为: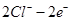 =
= ↑
↑
D.当有0.1 mol  通过离子交换膜,X电极上产生1.12 L气体(标准状况)
通过离子交换膜,X电极上产生1.12 L气体(标准状况)
参考答案:D
本题解析:当闭合开关K时,电极X附近溶液先变红,石墨X电极是阴极,氢离子放电,破坏水的电离平衡,从而产生OH-,电极A是负极,B是正极,选项C不正确。原电池中阳离子向正极移动,所以 从左到右通过离子交换膜,A不正确;负极失去电子,根据总的反应式可知,负极X是S22-失去电子,B不正确;根据电子的都是守恒可知,通过0.1mol电子时,X电极生成氢气是0.5mol,所以答案选D。
从左到右通过离子交换膜,A不正确;负极失去电子,根据总的反应式可知,负极X是S22-失去电子,B不正确;根据电子的都是守恒可知,通过0.1mol电子时,X电极生成氢气是0.5mol,所以答案选D。
本题难度:一般
3、实验题 如图所示3套实验装置,分别回答下列问题。
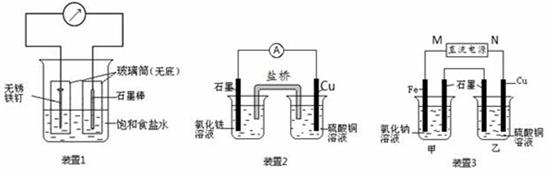
(1)装置1为铁的吸氧腐蚀实验。一段时间后,溶液略显浅绿色,表明铁被?(填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为?。
(2)装置2中的石墨是?极(填“正”或“负”),该装置发生的总反应的离子方程为?。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为?极;甲烧杯中铁电极的电极反应为?。
②乙烧杯中电解反应的离子方程式为?。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为?mL。
参考答案:(1)氧化(2分)? O2+ 4e- +2H2O=4OH-(2分)
(2)正(2分) ?2Fe3++Cu =2Fe2++Cu2+(2分)
(3)①正(2分)?Fe-2e-=Fe2+(2分)
②2Cu2++2H2O 2Cu+O2↑+4H+(3分)
2Cu+O2↑+4H+(3分)
③224(2分)
本题解析:试题分析:(1)装置1为铁的电化学腐蚀,铁钉附近的溶液有蓝色沉淀,表明铁被氧化,铁为负极,碳为正极。观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O=4OH-。
(2)装置2为原电池,负极为Cu,铜失去电子,生成铜离子而溶解。石墨是正极,溶液中的铁离子得到电子生成亚铁离子,所以总的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,即石墨是阴极,所以铁是阳极,M是电源的正极,则铁电极的方程式是Fe-2e-=Fe2+。
②乙烧杯电解硫酸铜溶液,石墨为阳极,铜是阴极,所以电解的总方程式是2CuSO4+2H2O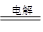 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g÷64g/mol =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol
根据甲烧杯产生气体的电极反应可知
2H++2e-=H2↑
2mol? 22.4L
0.02mol ?V
所以V=0.224L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,侧重考查学生分析问题、解决问题的能力。做题时要注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算即可。
本题难度:一般
4、选择题 下列说法不正确的是
A.镀锡的铁片镀层破损后,腐蚀速率加快
B.Fe在食盐水中被腐蚀,其负极反应为 O2 +2H2O + 4e- = 4OH-
C.可用被保护金属与直流电源负极相接的方法来减慢腐蚀速率
D.电解法精炼铜时,阳极材料应用粗铜
参考答案:B
本题解析:
答案:B
B. Fe在食盐水中被腐蚀,其负极反应为:Fe―2e-=Fe2+
A 正确,铁比锡活沷
C 正确,外加电流的阴极保护法
D 阳极粗铜溶解。
本题难度:简单
5、填空题 写出下列反应的化学方程式:
①制备玻璃的2个反应:__________________________,__________________________;
②钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人,造成钢铁锈蚀的主要原因是发生电化学腐蚀。在电化学腐蚀中,水膜酸性较弱或呈中性时,发生吸氧腐蚀,其电极反应为:正极:O2+2H2O+4e-=4OH,负极:________________________________。水膜酸性较强时,发生析氢腐蚀,其电极反应为:正极:______________________________;
③某抗酸药(碳酸氢钠)与胃酸(主要成分是盐酸)发生反应的化学方程式:______________________________。
参考答案:①SiO2+Na2CO3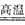 Na2SiO3+CO2↑;SiO2+CaCO3
Na2SiO3+CO2↑;SiO2+CaCO3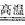 CaSiO3+CO2↑
CaSiO3+CO2↑
②Fe-2e-=Fe2+;2H++2e-=H2↑
③NaHCO3+HCl=NaCl+H2O+CO2↑
本题解析:
本题难度:一般