1、填空题 实验室常用二氧化锰与浓盐酸反应来制取氯气?。
MnO2+4HCl(浓)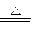
 ? MnCl2+Cl2↑+2H2O?
? MnCl2+Cl2↑+2H2O?
现用200克36.5%的浓盐酸(过量)与17.4克二氧化锰反应, 试回答下列问题:
(1)理论上可制得标准状况下的氯气的体积为?L
(2)将反应后剩余的溶液用水稀释至500mL,则稀释后溶液HCl的物质的量浓度是?
2、选择题 下列叙述正确的是 (NA为阿伏伽德罗常数)(? )
A.标况下,22.4L苯的分子数为NA
B.48 g O3气体含有NA个O3分子
C.1L的0.5 mol·L-1 CuCl2溶液中含有0.5NA个Cu2+
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
3、选择题 为了配制100mL?1mol-L-1NaOH溶液,其中有下列几个操作:
①NaOH用纸盛载进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH在烧瓶里刚好完全溶解,立即把溶液转移到溶量瓶;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹面恰好跟刻度相切.
其操作错误的是( )
A.①②③
B.③④⑤
C.②③⑤
D.①③⑤
4、选择题 硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当SO42-的浓度为0.20 mol·L-1时,加入等体积的0.20 mol·L-1的KOH溶液(混合溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么反应前溶液中K+的浓度为
A.0.20 mol·L-1
B.0.25 mol·L-1
C.0.225 mol·L-1
D.0.45 mol·L-1
5、填空题 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______;
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:____ ___ ;若反应中生成0.2 mol HNO3,转移的电子数目为______个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是____________ ;一旦NF3泄漏,可以用 溶液(填化学式)喷淋的方法减少污染。