1、选择题 下列物质中,主要成分属于硅酸盐的是
A.烧碱
B.水泥
C.石灰石
D.胆矾
参考答案:B
本题解析:硅酸盐指由硅、氧、金属组成的化合物的总称。A、烧碱属于碱类,错误;B、水泥属于硅酸盐材料,正确;C、石灰石不含硅元素,错误;D、胆矾不含硅元素,错误,答案选B。
本题难度:简单
2、选择题 分类是学习化学的方法之一.下列各组物质是按单质、氧化物、混合物、盐的顺序排列的是( )
A.氧气、水、空气、氢氧化钠
B.氮气、氯酸钾、钢、醋酸钠
C.可燃冰、干冰、冰水混合物、氯化锰
D.石墨、生石灰、石油、小苏打
参考答案:D
本题解析:A中的氢氧化钠是碱,不是盐。B中的氯酸钾是盐,不是氧化物。C中的可燃冰是甲烷,不是单质,冰水混合物是纯净物,不是混合物。所以正确的答案选D。
本题难度:简单
3、选择题 家庭日常生活经常用到的下列物质中,属于纯净物的是(?)
A.调味用的食醋
B.纯水降温得到的冰水混合物
C.炒菜用的铁锅
D.餐饮用的啤酒
参考答案:B
本题解析:B:冰是固态水,纯水降温得到的冰水混合物仍然是纯净的水,属于纯净物,故故选B
点评:本题选项B属于易错项,由纯水降温得到的冰是固态水,所以冰水混合物也是纯净物
本题难度:简单
4、选择题 NaOH、Na2CO3、NaCl、Na2SO4可按不同标准分类,下列分类标准不正确的是
A.钠的化合物
B.电解质
C.可溶于水
D.钠盐
参考答案:D
本题解析:四物质均为可溶于水的钠的化合物,均为电解质,但其中NaOH为碱,D项不正确
本题难度:一般
5、填空题 铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是?。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:?。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是?;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=?mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是?。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
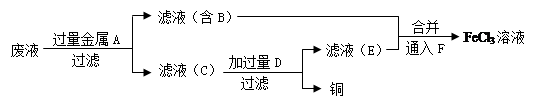
①滤渣C的化学式为?。
②加过量D发生反应的离子方程式为?。
③通入F发生反应的化学方程式为?。
参考答案:(1)用平行光照射两种分散系(或丁达尔现象)
(2)2Fe3++Cu=2Fe2++Cu2+
(3)①Fe3+、Fe2+、Cu2+?②3 ?③B
(4)①Fe、Cu?②Fe+2H+=Fe2++H2↑?③2FeCl2+Cl2=2FeCl3
本题解析:(1)胶体会产生丁达尔效应,但是溶液不能。因此鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系(或丁达尔现象)。(2)FeCl3有氧化性,能把铜氧化为Cu2+。反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+。(3)①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是Fe3+;由于发生了反应2Fe3++Cu=2Fe2++Cu2+,所以溶液中还含有Fe2+、Cu2+。②n(AgCl)= n(Cl-)=21.525g÷143. 5g/mol="0.15mol." 则溶液中c(Cl-)=n(Cl-)÷V=0.15mol÷0.05L=3mol/L。③A.因为溶液中含有Fe3+,Fe3+的黄色要比Fe2+的浅绿色深,所以无法看出该现象。错误。B.Fe2+有还原性,容易被酸性高锰酸钾溶液氧化而使之褪色。因此若看到溶液褪色,证明含有Fe2+。正确。C.原溶液中含有Fe3+,所以无论是否滴入氯水,都会发生该现象。错误。因此正确选项为B。(4)向反应后的溶液中加入过量的金属Fe,发生反应:Fe+CuCl2=FeCl2+Cu,,然后过滤得到滤液B中含有FeCl2;滤渣C中含有Fe、Cu。向滤渣中加入过量的盐酸,发生反应:Fe+2HCl= FeCl2+ H2↑. 离子方程式为:Fe+2H+= Fe2++H2↑。滤液E中含有FeCl2,将其与滤液B混合,然后向该溶液中滴加新制的过量的氯水,发生反应2FeCl2+Cl2=2FeCl3。最后得到FeCl3溶液。
本题难度:简单