1、选择题 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是?
 ?
? 
[? ]
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
参考答案:C
本题解析:
本题难度:一般
2、填空题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中的化学方程式有______;______.
(2)硫酸铜溶液可以加快氢气生成速率的原因是______;
(3)实验室中现有Na2SO4、Ag2SO4、MgSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是______;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答一种即可):______.
参考答案:(1)Zn比Cu活泼,可置换出Cu,反应的方程式为CuSO4+Zn=ZnSO4+Cu,Zn为活泼金属,可置换出氢气,反应的方程式为Zn+H2SO4=ZnSO4+H2↑,
故答案为:CuSO4+Zn=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑;
(2)Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,而加快化学反应速率,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率;
(3)所给四种溶液中只Zn只能置换出Ag,即Ag2SO4与CuSO4溶液具有相似的作用,故答案为:Ag2SO4;
(4)为加快Zn和硫酸的反应速率可从升温、适当增大硫酸的浓度、增大锌的比表面积等角度考虑,
故答案为:增加锌的表面积、升高温度或适当增大硫酸的浓度等(答一种即可).
本题解析:
本题难度:简单
3、填空题 取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应.甲加入50mLpH=2盐酸,乙加入50mL?pH=2醋酸,丙加入50mL?pH=2醋酸及少量的胆矾粉末.
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为______(以上用“甲、乙”和“>、<、=”回答)
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌.回答以下问题.
①三支试管中参加反应的锌的质量大小关系为:______(用“甲、乙、丙”和“>、<、=”回答)
②反应终了,所需时间为:______(同①)
③若以上三组实验,锌粉均过量,产生的氢气体积______(同①)
参考答案:(1)pH相等的盐酸和醋酸中,C(CH3COOH)>C(HCl),则等体积和等pH的盐酸和醋酸,n(CH3COOH)>n(HCl),生成氢气的体积相同,则消耗酸的物质的量相同,所以醋酸过量,则醋酸溶液中锌不足,而盐酸溶液中锌有剩余,故甲>乙,
故答案为:甲>乙;?
(2)①若反应终了生成氢气的体积一样多,且没有剩余的锌,则甲、乙、丙中与酸反应的锌的质量相同,但丙中锌还和铜离子发生置换反应,所以丙中消耗锌最多,而甲和乙中消耗锌的质量相同,故答案为:丙>甲=乙;
②丙中锌置换出铜,铜、锌和酸构成原电池而加快反应速率,反应过程中,乙中氢离子浓度大于甲,所以乙中反应速率大于甲,反应终了,所需时间为:甲>乙>丙,故答案为:甲>乙>丙;
③乙和丙中醋酸的物质的量相同,甲中酸的物质的量小于丙和乙,且盐酸和醋酸都是一元酸,所以若以上三组实验,锌粉均过量,产生的氢气体积乙=丙>甲,故答案为:乙=丙>甲.
本题解析:
本题难度:一般
4、选择题 下列图示与对应叙述相符的是( )
A.

反应达到平衡后,升高温度,平衡常数K值变大
B.
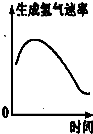
表示镁条放入盐酸中生成氢气速率随时间的变化
C.
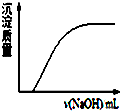
表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化
D.
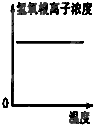
表示纯碱溶液受热时氢氧根浓度随温度的变化
参考答案:A.由图象可知,反应物总能量大于生成物总能量,反应放热,升高温度平衡向逆反应方向移动,平衡向平衡常数K值减小,故A错误;
B.镁条放入盐酸中,反应放热,随着反应的进行,盐酸的浓度逐渐降低,则开始时反应速率增大,后来反应速率减小,故B正确;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,反应为:HCO3-+OH-=CO32-+H2O,CO32-+Ca2+=CaCO3↓,则一开始就有沉淀生成,故C错误;
D.纯碱溶液受热时水解程度增大,OH-浓度增大,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 现有下列四个图象,下列反应中全部符合上述图象的反应是( )

A.N2(g)+3H2(g)?2NH3(g);△H<0
B.2SO3(g)?2SO2(g)+O2(g);△H>0
C.4NH3(g)+5O2(g)?4NO+6H2O(g);△H<0
D.H2(g)+CO(g)?C(s)+H2O(g);△H>0
参考答案:由第一个和第二个图象可知升高温度生成物的浓度增大,说明平衡向正反应方向移动,说明正反应放热,可排除A、C选项,
由第一个、第二个和第四个图象可知压强增大生成物的浓度减小,说明压强增大平衡向逆反应方向移动,则反应物的气体的计量数之和大于生成物气体的化学计量数之和,可排除D选项,故选B.
本题解析:
本题难度:一般