1、选择题 化学中常借助图象来表示某种变化过程,下列关于4个图象的说法正确的是( )
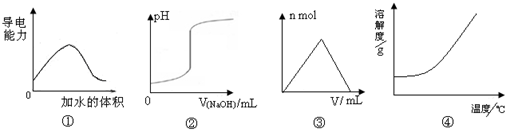
A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化
B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化
C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化
D.图④可表示所有的固体物质溶解度随温度的变化
参考答案:A.溶液导电性强弱取决于溶液中离子浓度的大小,纯净的醋酸不存在离子不导电,图象起点错误;故A错误;
B.向一定量的盐酸溶液中滴加一定浓度的氢氧化钠,溶液pH逐渐增大;故B正确;
C.向一定量的明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀逐渐增大,当Ba2+完全沉淀之后,生成的氢氧化铝继续与OH-离子反应,沉淀部分溶解;故C错误;
D.氯化钠随温度的增大变化不大.氢氧化钙溶解度随温度升高减小;故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 1mL?pH值相同的醋酸和盐酸,分别用蒸馏水稀释到100mL,稀释后两溶液的pH?分别为m和n( )
A.m>n
B.m=n
C.m<n
D.不能确定
参考答案:C
本题解析:
本题难度:简单
3、选择题 在0.l mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH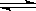 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.升温,平衡向正反应方向移动,溶液的pH值不变
B.加水,反应速率加快,平衡向逆反应方向移动
C.滴加少量0.lmol·L-1 HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向逆反应方向移动
参考答案:D
本题解析:升高温度,促进电离,氢离子浓度增大,pH减小,A不正确;稀释促进电离,B不正确;加入盐酸,抑制醋酸的电离,但溶液中氢离子浓度增大,C不正确。D中增大CH3COO-浓度,抑制醋酸的电离,D正确,答案选D。
点评:该题是基础性试题的考查,主要是考查学生对醋酸电离平衡状态以及外界条件对醋酸电离平衡状态影响的了解掌握情况,旨在培养学生分析、归纳、总结问题的能力。有利于培养学生的逻辑推理能力和应试能力。
本题难度:一般
4、选择题 下列溶液中各微粒的浓度关系不正确的是( )
A.0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+(OH-)
C.CH3COONa溶液中:c(Na+)>c(CH3COO-)>(OH-)>c(H+)
D.Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
参考答案:A、CH3COOH溶液中根据醋酸根守恒可知,c(CH3COO-)+c(CH3COOH)=0.1mol/L,故A正确;
B、NaHCO3溶液不显电性,所以阳离子带的正电荷总数等于阴离子带的负电荷总数,则c(H+)+c(Na+)=2c(CO32-)+
c(HCO3-)+(OH-),故B正确;
C、CH3COONa溶液中,CH3COONa═CH3COO-+Na+,因醋酸根离子水解显碱性,则c(Na+)>c(CH3COO-)、(OH-)>c(H+),水解的程度不大,则c(CH3COO-)>(OH-),故C正确;
D、Na2S溶液,n(Na)=2n(S),由物料守恒可知,12c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误;
故选D.
本题解析:
本题难度:一般
5、选择题 下列说法中,能说明酸HA的酸性比酸HB的酸性强的是
A.同温、同浓度的钠盐溶液PH:NaA>NaB
B.PH相同的HA,HB的酸溶液,稀释相同倍数后,PH:HA<HB
C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多
D.同温、同浓度的两种酸溶液,HA的电离程度大于HB的电离程度
参考答案:D
本题解析:A.根据“越弱越水解”可知,NaA水解程度大,故HA的酸性弱。A错误。
B.PH相同的酸溶液,稀释相同倍数,酸性越弱的溶液PH增大的越小,故HA的酸性弱,B错误。
C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多,说明HA的浓度大,电离程度小,酸性弱,C错误。
D.同温、同浓度的两种酸溶液,电离程度越大酸性越强,故HA的酸性强,D正确。
故选D
本题难度:一般