1、选择题 对于相同质量的CO和CO2,下列说法中正确的是( )
A.分子数之比为1:1
B.原子总数之比为11:7
C.氧元素的质量比为11:14
D.碳元素的质量比为11:7
参考答案:CD
本题解析:
本题难度:简单
2、选择题 今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl2溶液200mL,0.1mol/L AlCl3溶液100mL,这三种溶液中Cl-物质的量浓度之比是
A.3∶4∶3
B.3∶2∶3
C.1∶2∶3
D.1∶1∶1
参考答案:C
本题解析:氯离子的物质的量浓度大小与溶液体积多少无关,0.1mol/L NaCl溶液300mL中氯离子浓度为0.1mol/L;0.1mol/L MgCl2溶液200mL中氯离子浓度为0.2mol/L;0.1mol/L AlCl3溶液100mL中氯离子浓度0.3mol/L;所以这三种溶液中Cl-物质的量浓度之比是1∶2∶3
本题难度:简单
3、选择题 一块表面已被氧化为氧化钠的钠块5.4g,投入50g水中,最多能产生0.10g气体,则原来被氧化的钠是(?)
A.2.3g
B.3.1g
C.4.6g
D.5.3g
参考答案:A
本题解析:根据钠和水反应生成氢氧化钠与氢气的化学方程式,找到题给的已知量氢气的质量,求得参加反应的钠的质量,再计算出被氧化的钠的质量。
设产生0.10g氢气需钠的质量为x
2Na+2H2O=2NaOH+H2↑
46g? 2g
x?0.1g
解得x=2.3g
则氧化钠的质量是5.4g-2.3g=3.1g
则对应的被氧化的钠的质量为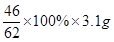 =2.3g
=2.3g
答案选A。
点评:该题是中等难度的试题,侧重对学生答题能力的培养,有利于培养学生的规范答题能力。根据化学方程式计算时,反应物和生成物的质量关系都是纯量,注意解题格式要规范完整,另外本题还要注意审题,被氧化的钠和氧化钠是两码事,不能混淆。
本题难度:一般
4、实验题 (16分)用18 mol/L 浓硫酸配制100 mL 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是________________________________。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________?
D.定容时俯视刻度线________________?
参考答案:(1)16.7 mL? B
(2)先向烧杯加入30mL (或适量)蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌
(3)继续向容量瓶注入蒸馏水至离刻度线1~2 cm处,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止;塞紧瓶塞,倒转摇匀
(4)A.偏小 B.无影响 C.偏小 D.偏大
本题解析:考查一定物质的量浓度溶液的配制以及有关误差分析等。
(1)由于在稀释过程中溶质是不变的,所以需要浓硫酸的体积是
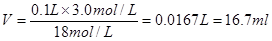 。根据规格相近的原则可知,应该选择25ml量筒,即答案选B。
。根据规格相近的原则可知,应该选择25ml量筒,即答案选B。
(2)由于浓硫酸溶于水放出大量的热,所以正确的稀释方法是:先向烧杯加入30mL (或适量)蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌。
(3)定容需要胶头滴管,所以正确的操作是:继续向容量瓶注入蒸馏水至离刻度线1~2 cm处,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止;塞紧瓶塞,倒转摇匀。
(4)根据c=n/V可知,由于浓硫酸易吸水,所以所用的浓硫酸长时间放置在密封不好的容器中,则溶质减少,浓度偏小;若容量瓶用蒸馏洗涤后残留有少量的水,不会影响实验结果;若所用过的烧杯、玻璃棒未洗涤,则溶质减少,浓度偏小;若定容时俯视刻度线,则容量瓶中溶液的体积减少,浓度偏大。
本题难度:一般
5、填空题 同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为 ,其密度比为 ? ;若质量相等时,两种气体的体积比 ? 。
参考答案:16:1? 16:1? 1:16
本题解析:同温同压下的氧气和氢气,若体积相同时,则具有相同的摩尔数,所以两种气体的质量比为32:2=16:1;密度之比为质量之比,即为 16:1;质量相等时,设为32g,所以根据阿伏加德罗定律的推论可以知道,体积比为摩尔比,即两种气体的体积比为
(32/32):(32/2)= 1:16。
点评:本题考查了阿伏加德罗定律的推论的计算,是高考考查的重点和难点,但是本题的难度不大。
本题难度:一般