1、选择题 下列实验操作与预期实验目的或所得实验结论一致的是?(?)
选项
| 实验操作
| 实验目的或结论
|
A
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拦一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
B
| 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失
| 证明溶液中含SO42-
|
C
| 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊
| 证明该溶液中存在CO32-
|
D
| 向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色
| 证明Fe2+具有氧化性
|
?
参考答案:A
本题解析:略
本题难度:一般
2、实验题 (14分)氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域。在氮气流中由氧化铝与焦炭在电炉中加热制得。原料配比不当或反应不完全等因素都会造成产品中含有碳、Al4C3或Al2O3等杂质。回答下列问题:
(1)反应Al2O3+N2+ 3C  2AlN+3CO中,氧化剂是??。
2AlN+3CO中,氧化剂是??。
(2)AlN也可以与强碱溶液反应。完成下列方程式:
AlN+NaOH+H2O=???+????
(3)Al 4C3与水反应生成甲烷,反应方程式是
甲烷与CuO反应的化学方程式如下:
CH4+4CuO  CO2+2H2O+4Cu
CO2+2H2O+4Cu
为测定产品中有关成分的含量,所需仪器如下:
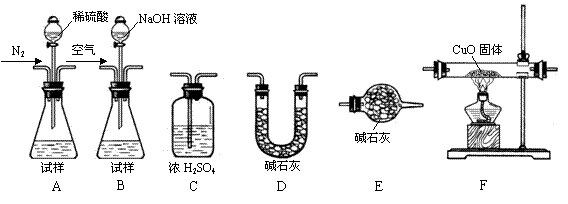 Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接
Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接 的顺序为A→C→F→C→D→E。主要实验步骤
的顺序为A→C→F→C→D→E。主要实验步骤 如下:
如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N2
⑤再次缓缓鼓入一定量的N2
⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→?→⑤→⑥→⑦,操作④的目的是? ??。
??。
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
?→??→??→E
若试样为mg,测得C增重n g,则AlN的质量分数是?。
参考答案:(14分)(1)N2?
(2)NaAlO2、NH3
(3)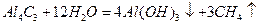
Ⅰ.④→③→②
将装置中的空气排尽,防止爆炸
Ⅱ.?B→D→C?
?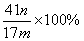
本题解析:略
本题难度:一般
3、选择题 下列有关实验操作、现象和解释或结论都正确的是 (? )
选项
| 实验操作
| 现象
| 解释或结论
|
A
| 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
| 溶液呈红色
| 稀HNO3将Fe氧化为Fe3+
|
B
| AgI沉淀中滴入稀KCl溶液
| 有白色沉淀出现
| AgCl比AgI更难溶
|
C
| 常温下,向饱和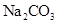 溶液中加少量 溶液中加少量 粉末,过滤,向洗净的沉淀中加稀盐酸 粉末,过滤,向洗净的沉淀中加稀盐酸
| 有气泡产生
| 不能说明常温下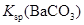
与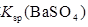 的大小关系 的大小关系
|
D
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上
| 试纸变蓝色
| 浓氨水呈碱性
参考答案:CD
本题解析:
正确答案:C、D
A、3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O,无Fe3+,滴入KSCN溶液,不呈红色。
B、AgCl+I―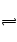 AgI+Cl―是可逆反应。 AgI+Cl―是可逆反应。
C、CO32―+BaSO4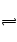 BaCO3+SO42―,是可逆反应,所以结论正确。 BaCO3+SO42―,是可逆反应,所以结论正确。
D、现象和结论均正确。
本题难度:简单
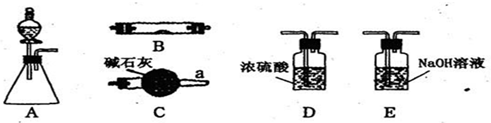
4、填空题 如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择.
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验H2的氧化产物.当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、______.
(2)若锥形瓶中盛装______固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O.
①各仪器装置按气流方向从左到右连接顺序A→C→B→E,请写出B中氨的催化氧化反应方程式______.
②装置C的作用是______.
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成.
若SO2与过氧化钠反应没有O2生成,根据气流方向,从图中世择适当的仪器进行实验,装置的连接顺序为(填字母):A→______→______→______,装置B中可能观察到的现象是______.
若有O2生成,实验室检验O2的方法是______.
参考答案:(1)第二次使用B装置的作用是检验产物水,可用无水硫酸铜,故答案为:无水硫酸铜;
(2)根据进行进行氨的催化氧化可知A为制取氧气的装置,故锥形瓶中盛装Na2O2,故答案为:Na2O2;
①氨的催化氧化反应方程式:4NH3+5O2=4NO+6H2O,故答案为:4NH3+5O2=4NO+6H2O;
②碱石灰可干燥气体,C的作用为除去水蒸气,干燥氨气和氧气,故答案为:除去水蒸气,干燥氨气和氧气;
(3)A生成的二氧化硫通过D浓硫酸可干燥二氧化硫,然后在B中与过氧化钠反应,再通过C除掉未反应的二氧化硫,若有氧气生成,则E中有气泡生成,反之则无;过氧化钠是淡黄色固体,与二氧化硫反应后生成硫酸钠白色固体,故B中现象为淡黄色固体粉末变为白色;实验室检验O2的方法是用带火星木条放到导气管出口,木头复燃证明有氧气,
故答案为:D;B;C/E;淡黄色固体粉末变为白色;用带火星木条放到导气管出口,木头复燃证明有氧气;
本题解析:
本题难度:一般
5、填空题 某化学研究性学习小组为了探究四氯化锡的有关性质,拟先利用下列装置和药品进行四氯化锡的制备.已知四氯化锡具有强的吸水性,SnCl4和Sn的部分数据如下
| 密度 | 熔点 | 沸点
四氯化锡
2.2g?cm-3
-33℃
114℃
金属锡
5.77g?cm-3
231℃
|
供选择的药品:Sn、浓HC1、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰仪器装置:
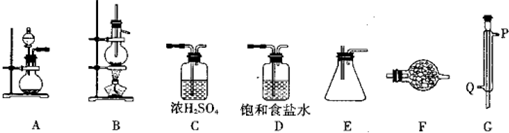
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→______→______→______→______→______→______;
(2)仪器G的名称是______;实验时,G中冷却水的流向是从______进入(填符号);
(3)A中发生反应的离子方程式为______;
(4)F中盛装的化学试剂是______;其作用是______;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示)______.
参考答案:(1)用A制备氯气,分别在D、C中进行除杂和干燥,然后在B中发生反应制备SnCl4,冷却后在E中收集,最后连接F,进行尾气吸收,连接顺序为D→C→B→G→E→F,
故答案为:D→C→B→G→E→F;
(2)G为冷凝管,为达到充分冷凝的效果,应从Q进水,从P出水,故答案为:冷凝管;Q;
(3)A中制备氯气,在不加热的条件下进行,应用高锰酸钾和浓盐酸制备,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装碱石灰,具有碱性,可与水或酸性气体反应,防止空气中的水分进入装置E中,吸收多余的Cl2防止污染,
故答案为:碱石灰;防止空气中的水分进入装置E中,吸收多余的Cl2防止污染;
(5)金属性:Pb>Sn>Ge,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则Pb(OH)4>Sn(OH)4>Ge(OH)4,
故答案为:Pb(OH)4>Sn(OH)4>Ge(OH)4.
本题解析:
本题难度:一般
|