1、选择题 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的?
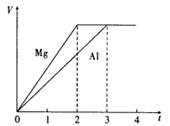
A.摩尔质量之比为2:3
B.物质的量之比为3:2
C.质量之比为3:2
D.反应速率之比为2:3
参考答案:B
本题解析:由题意知,酸均过量,产生的氢气相同,由方程式:
Mg+2H+=Mg2++H2↑? 2Al+6H+=2Al3++3H2↑
可知:镁铝的物质的量之比为3:2;质量比为4:3;速率与时间成反比即3:2;两者的摩尔质量比为8:9
故答案为B
本题难度:一般
2、选择题 将已打磨过的铁棒放入冷浓硫酸中,一段时间后取出,若由你设计一个实验证明铁表面已形成致密氧化膜,你需要用下列哪一种试剂
A.稀硫酸
B.稀盐酸
C.硫酸铜溶液
D.氢氧化钠溶液
参考答案:C
本题解析:试题分析:铁遇浓硫酸发生钝化,铁表面被氧化生成一层致密的氧化物保护膜。稀硫酸、稀盐酸能与氧化膜及铁反应,硫酸铜与氧化膜不反应但可与铁反应,氢氧化钠溶液与氧化膜和铁都不反应,所以应选择硫酸铜溶液。
考点:元素及其化合物
点评:常温下,铁、铝遇浓硫酸、浓硝酸发生钝化,所以可用铝槽车装运浓硫酸或浓硝酸,但加热则可以发生反应。
本题难度:困难
3、选择题 下列叙述不正确的是
A.工业上可用碳在高温下还原二氧化硅制取硅
B.工业上可用氯气和石灰乳为原料制造漂白粉
C.镁条不能在二氧化碳气体中燃烧
D.将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路
参考答案:C
本题解析:分析:A.工业上用碳在高温下还原二氧化硅的方法可制得硅;
B.工业上可用氯气和石灰乳为原料制造漂白粉;
C.镁条能在二氧化碳气体中燃烧;
D.根据胶体具有丁达尔效应;
解答:A.工业上用碳在高温下还原二氧化硅的方法可制得硅,故A正确;
B.工业上可用氯气和石灰乳为原料制造漂白粉,故B正确;
C.镁条能在二氧化碳气体中燃烧,故C错误;
D.根据胶体具有丁达尔效应,所以将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路,故D正确;
故选:C;
点评:本题主要考查了物质的工业制法和物质的性质,难度不大,注意知识的积累.
本题难度:困难
4、选择题 下列不属于铵盐的共同性质的是
A.与烧碱反应共热产生氨气
B.都易溶于水
C.受热分解都产生氨气
D.都是晶体
参考答案:C
本题解析:试题分析:铵盐中都有铵根离子,与氢氧化钠共热都有氨气产生,铵盐都易溶于水,铵盐都是晶体,铵盐受热分解不一定产生氨气,如硝酸铵受到撞击分解生成氮气、氧气和水,D错误。
考点:铵盐的性质
点评:组成铵盐的酸若具有氧化性,则该铵盐受热分解一般不生成氨气。
本题难度:一般
5、选择题 氢氧化铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜.在高温下这两种化合物均能分解生成氧化铜.溶解25.25g上述混合物,恰好消耗1.0?mol?L-1?盐酸500mL.灼烧等量的上述混合物,得到的氧化铜质量为
A.15?g
B.20?g
C.30?g
D.35?g
参考答案:B
本题解析:分析:混合物与盐酸恰好反应生成CuCl2,根据氯元素守恒计算CuCl2的物质的量,根据铜元素守恒计算混合物灼烧生成CuO的物质的量,再根据m=nM计算氧化铜的质量.
解答:混合物与盐酸恰好反应生成CuCl2,根据氯元素守恒可知n(CuCl2)=0.5L×1mol/L× =0.25mol,
=0.25mol,
根据Cu元素质量守恒可知,n(CuO)=n(CuCl2)=0.25mol,
故m(CuO)=0.25mol×80g/mol=20g,
故选B.
点评:本题考查混合物的有关计算,难度中等,关键在于利用守恒思想进行解答.
本题难度:困难