1、选择题 常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是
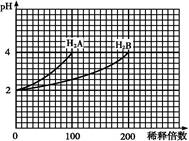
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
2、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是(?)
A.溶液中导电粒子的数目减少
B.溶液中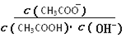 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH<7
3、选择题 在0.1mol·L-1的CH3COOH溶液中存在如下电离平衡CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量冰醋酸,溶液的pH减小,CH3COOH的电离度增大。
B.滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少。
C.加入少量Na2CO3固体,平衡不移动
D.加水稀释,可使溶液中c(H+)/c(CH3COOH)值增大。